
【题目】已知反应![]() ,某温度下的平衡常数为4,此温度下,在2L的密闭容器中加入amolA,反应到某时刻测得各组分的浓度如下表,则下列说法中正确的是
,某温度下的平衡常数为4,此温度下,在2L的密闭容器中加入amolA,反应到某时刻测得各组分的浓度如下表,则下列说法中正确的是

A. a=1.0
B. 此时刻正反应速率小于逆反应速率
C. 在相同条件下,若起始时加入2amolA,则达到平衡时A的转化率减小
D. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
科目:高中化学 来源: 题型:
【题目】在25 ℃、1.01×105 Pa下,反应2N2O5(g)4NO2(g)+O2(g) ΔH=+56.7 kJ·mol-1能自发进行的合理解释是( )
A. 该反应是分解反应
B. 该反应的熵增效应大于焓变效应
C. 该反应是熵减反应
D. 该反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),CH3OH(g) + H2O(g)![]() CO2(g) + 3H2(g)
CO2(g) + 3H2(g) ![]() H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的____________倍。
②该条件下反应达平衡状态的依据是(填序号)_______________。
A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热Q kJ。则表示甲醇燃烧热的热化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3的催化氧化是工业制取硝酸的关键步骤之一,该反应的化学方程式为:
4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),△H<0。
4NO(g)+6H2O(g),△H<0。
请回答下列问题:
(1)在恒温恒容下判断该反应达到平衡状态的标志是________(填字母)。
a.NH3和NO浓度相等
b.NO百分含量保持不变
c.容器中气体的压强不变
d.NH3的生成速率与NO的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3平衡转化率的是_____________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2 c.改变反应的催化剂 d.降低温度
(3)将0.050 mol NH3 (g)和0.060 mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(NO)=0.040 mol/L。计算该条件下反应的NH3的转化率和写出平衡常数K 的表达式(不必写出计算过程)。
①平衡常数的表达式K=________________;
②平衡时,NH3的转化率α(NH3 )=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物用C6H10O5表示。下列有关说法正确的是
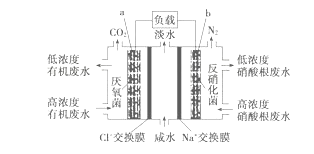
A. b电极为该电池的负极
B. b电极附近溶液的pH减小
C. a电极反应式:C6H10O5-24e-+7H2O===6CO2↑+24H+
D. 中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应A2 + B2 ![]() 2AB △H= Q kJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是
2AB △H= Q kJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是

A. Q >0
B. A2、B2中最少有一种是气态物质
C. b对应的平衡状态时化学反应速率比c对应的平衡状态时化学反应速率大
D. AB一定是气体物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍元素性质与铝元素性质相似,下列方法能证明氯化铍由共价键构成的是( )
A. 溶于水加硝酸银溶液,观察是否有白色沉淀生成
B. 溶于水做导电实验,观察是否导电
C. 熔融状态,做导电实验,观察是否导电
D. 测定氯化铍熔点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com