

| A. | 从海水中提取溴,一般要经历浓缩、氧化、还原富集和再氧化等步骤 | |
| B. | 利用溴的挥发性,鼓入热空气或水蒸气,就可将溴吹出来 | |
| C. | 第②步发生反应的离子方程式为:SO2+Br2+2H2O═4H++2Br-+SO42- | |
| D. | 要除去产品溴中的少量氯气,可依次加入NaOH溶液及苯 |
分析 海水经日光晒得到粗盐和苦卤,在苦卤中通入氯气发生溴单质,步骤②通入二氧化硫,且通入空气,可将溴从溶液中吹出来,溴与二氧化硫发生氧化还原生成氢溴酸,然后通入氯气,可将HBr氧化生成溴,以达到富集的目的,以此解答该题.
解答 解:A.由流程可知从海水中提取溴,一般要经历浓缩、氧化、还原富集和再氧化等步骤,故A正确;
B.溴易挥发,鼓入热空气或水蒸气,就可将溴吹出来,生成氢溴酸以达到富集的目的,故B正确;
C.二氧化硫吸收溴单质,Br元素的化合价由0降低为-1价,Br2在反应中作氧化剂,表现氧化性,S元素的化合价由+4价升高到+6价,SO2作还原剂,发生反应:Br2+SO2+2H2O═4H++SO42-+2Br-,故C正确;
D.溴、氯气都可与氢氧化钠溶液反应,不能用氢氧化钠溶液除杂,故D错误.
故选D.
点评 本题考查海水资源的利用,为高频考点,侧重于学生的分析能力的考查,学生应熟悉粗盐提纯及物质转化中的化学反应并利用信息来综合解答,在物质转化中应学会利用组成的差异来选择合适的试剂,难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠和冷水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 将氯气通入水中:Cl2+H2O=Cl-+HClO+H+ | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
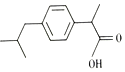
| A. | 布洛芬属于苯的同系物 | B. | 能与NaOH溶液反应 | ||
| C. | 所有原子在同一平面上 | D. | 能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为1:1.
,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为1:1.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 C2H4 C3H4 | B. | C2H6 C3H6 C4H6 | ||
| C. | CH4 C2H6 C3H8 | D. | C2H4 C2H2 CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、反应类型取代反应
、反应类型取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的化合物可能含有非极性键 | |
| B. | X的单质与Z的单质在暗处能剧烈反应 | |
| C. | 含W的盐溶于水形成的溶液常用于自来水的杀菌消毒 | |
| D. | 离子半径:r(Z-)>r(W3+) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com