
 .
. 分析 6.02×1022个阳离子说明金属的物质的量为0.1mol,则原子中电子数为$\frac{1.2mol}{0.1mol}$=12,中子数为$\frac{7.224×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1.2mol,中子数为$\frac{1.2mol}{0.1mol}$=12,再根据M=$\frac{m}{n}$求出摩尔质量,摩尔质量在数值上近似等于质量数,利用质子数+中子数=质量数求出质子数,从而确定原子序数和元素符号
解答 解:(1)2.4g金属与盐酸反应得到6.02×1022,则金属的物质的量为$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.1mol,
则原子中电子数为$\frac{1.2mol}{0.1mol}$=12,中子数为$\frac{7.224×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1.2mol,中子数为$\frac{1.2mol}{0.1mol}$=12,
故该原子的摩尔质量为$\frac{2.4g}{0.1mol}$=24g/mol,摩尔质量在数值上近似等于质量数,质子数=质量数-中子数=24-12=12,该金属元素符号为Mg,
故答案为:Mg;24g/mol;
(2)该Mg原子内含有12个中子;
故答案为:12;
(3)氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为: ,
,
故答案为: .
.
点评 本题考查了原子中的质子数、中子数以及电子数之间的关系,侧重于学生的分析、计算能力的考查,题目难度不大,根据各微粒数之间的关系求出质子数确定元素是解题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 请回答下列问题.
请回答下列问题.| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | ① | ② | ② | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 |
| A. | ⑦①可形成离子化合物 | |
| B. | 元素②⑥形成的化合物具有两性 | |
| C. | 元素②氢化物的沸点小于元素⑤氢化物的沸点 | |
| D. | 元素④气态氢化物的稳定性大于元素⑤气态氢化物的稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙醛能发生氧化反应但不能发生还原反应 | |
| B. | 苯酚能与溴水发生取代反应 | |
| C. | 酯化反应是可逆反应 | |
| D. | 乙醇和乙醚互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青蒿素属于烃 | B. | 青蒿素属于烷烃 | ||
| C. | 青蒿素属于无机化合物 | D. | 青蒿素属于有机化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与金属钠反应产生氢气:CH3CH2OH+Na→CH3CH2ONa+H2↑ | |
| B. | 苯与浓硫酸、浓硝酸的混合溶液共热制硝基苯: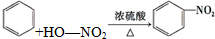 | |
| C. | 乙酸与乙醇发生反应生成乙酸乙酯:CH3CH2OH+CH3COOH$→_{△}^{催化剂}$CH3COOCH2CH3 | |
| D. | 乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2BrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将甲、乙作电极组成原电池时,甲是负极 | |
| B. | 同价态的阳离子,甲比乙的氧化性强 | |
| C. | 甲与稀盐酸反应放出氢气的体积比乙与稀盐酸反应放出氢气的体积大 | |
| D. | 在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沼气是一种清洁的能源 | |
| B. | 使用沼气做能源是解决农村能源的主要途径 | |
| C. | 使用沼气给农民的生活带来了不便 | |
| D. | 使用沼气是对化学能的充分利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com