
 .
. 分析 X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,则X、Y、Z、W分别位于第ⅠA族、ⅣA族、ⅤA族、ⅦA族.核电荷数按照Y、Z、X、W的顺序增大,由于Y与Z的原子次外层的电子数为2,说明Y、Z含有两个电子层,则Y为C元素、Z为N元素.W、X原子次外层电子数为8,则W为Cl元素、X为Na元素.
解答 解:X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,则X、Y、Z、W分别位于第ⅠA族、ⅣA族、ⅤA族、ⅦA族.核电荷数按照Y、Z、X、W的顺序增大,由于Y与Z的原子次外层的电子数为2,说明Y、Z含有两个电子层,则Y为C元素、Z为N元素.W、X原子次外层电子数为8,则W为Cl元素、X为Na元素.
(1)由上述分析可知,X为钠元素,Y为碳元素,故答案为:钠;碳;
(2)Z为氮元素,处于周期表中第二周期VA族,W为Cl元素,处于周期表第三周期第ⅦA族,
故答案为:第二周期VA族;第三周期第ⅦA族;
(3)X的最高价氧化物为Na2O,Z的最高价氧化物对应水化物为HNO3,二者反应的化学方程式:Na2O+2HNO3═2NaNO3+H2O,
故答案为:Na2O+2HNO3═2NaNO3+H2O;
(4)由X和 W形成的一种化合物是NaCl,用电子式表示其形成过程为 ,
,
故答案为:NaCl; .
.
点评 本题考查结构性质位置关系应用,正确推断元素是解答该题的关键,有利于基础知识的巩固,掌握用电子式表示化学键或物质想形成.


科目:高中化学 来源: 题型:实验题
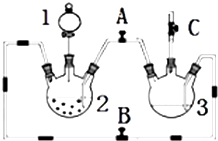 某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 部分卤代烃可用作灭火剂 | |
| B. | 甲醛的水溶液(福尔马林)可用于防腐 | |
| C. | 酚类化合物有毒,不能用于杀菌消毒 | |
| D. | 乙二醇可用于配制汽车防冻液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
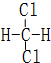 和
和 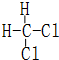 同一种物质.
同一种物质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
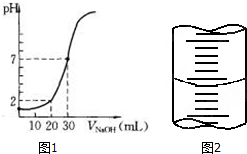 用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:
用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是银白色的柔软金属,密度都比水小 | |
| B. | 单质在空气中燃烧生成的都是过氧化物 | |
| C. | 单质的熔沸点随着原子序数的增加而升高 | |
| D. | 碱金属单质与水剧烈反应生成碱和氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 114号元素衰变成112号元素是化学变化 | |
| B. | 114号元素位于第12列 | |
| C. | ${\;}_{114}^{263}$X的中子数与质子数之差为149 | |
| D. | 112号元素位于周期表第七周期第ⅡB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com