
NA表示阿伏加德罗常数。下列说法正确的是
A.7.8 g Na2O2中含有的阴离子数目为0.2 NA
B.标准状况下,2.24 L CHCl3的分子数为0.1 NA
C.1 L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2 NA
D.0.1 mol Fe与足量稀HNO3反应,转移电子数为0.3NA
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:实验题
(15分)利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3?18H2O]。
I.实验室制取无色的无水AlBr3(熔点:97.5℃,沸点:263.3~265℃)可用如图所示装置,
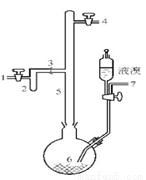
主要实验步骤如下:
步骤l.将铝箔剪碎,用CCl4浸泡片刻,干燥,然后投入到烧瓶6中。
步骤2.从导管口7导入氮气,同时打开导管口l和4放空,一段时间后关闭导管口7和1;导管口4接装有五氧化二磷的干燥管。
步骤3.从滴液漏斗滴入一定量的液溴于烧瓶6中,并保证烧瓶6中铝过剩。
步骤4.加热烧瓶6,回流一定时间。
步骤5.将氮气的流动方向改为从导管口4到导管口l。将装有五氧化二磷的干燥管与导管口1连接,将烧瓶6加热至270℃左右,使溴化铝蒸馏进入收集器2。
步骤6.蒸馏完毕时,在继续通入氮气的情况下,将收集器2从3处拆下,并立即封闭3处。
(1)步骤l中,铝箔用CCl4浸泡的目的是 。
(2)步骤2操作中,通氮气的目的是 。
(3)步骤3中,该实验要保证烧瓶中铝箔过剩,其目的是 。
(4)铝与液溴反应的化学方程式为 。
(5)步骤4依据何种现象判断可以停止回流操作 。
(6)步骤5需打开导管口l和4,并从4通入N2的目的是 。
II.某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示,实验中可选用的试剂:处理过的铝箔;2.0mol?L-1NaOH溶液:2.0 mol?L-1硫酸

(7)由铝箔制备硫酸铝晶体的实验步骤依次为:
①称取一定质量的铝箔于烧杯中,分次加入2.0 mol?L-1NaOH溶液,加热至不再产生气泡为止。
②过滤 ③ ;
④过滤、洗涤 ⑤ ;⑥ ;
⑦冷却结晶; ⑧过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏常州市高三第一次调研试卷化学试卷(解析版) 题型:填空题
(12分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子。
(1)基态的F3+核外电子排布式是 。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是 。
(3)化合物FD3是棕色固体、易潮解、100℃左右时升华,它的晶体类型是 ;化合物ECAB中的中的阴离子与AC2互为等电子体,该阴离子的电子式是 。

(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 。
(5)化合物EF[F(AB)6]是一种蓝色晶体,下图表示其晶胞的 (E+未画出)。该蓝色晶体的一个晶胞中E+的个数为 。
(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为 。
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示

其晶胞边长为540.0 pm,密度为 (列式并计算),a位置S2-离子与b位置Zn2+离子之间的距
离 pm(列式表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏常州市高三第一次调研试卷化学试卷(解析版) 题型:选择题
室温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=12的溶液中:AlO2-、Na+、SO 4 2-、SO32-
B.水电离出的c(H+)=10-12mol/L的溶液中:K+、Na+、SO 4 2-、AlO2-
C.能与铝反应生成氢气的溶液中:Mg2+、Na+、Cl-、NO3-
D.c(H+)=0.10mol/L的溶液中:CH3COO-、NH4+、Cl-、Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省肇庆市高三第一学期期末考试化学试卷(解析版) 题型:填空题
(15分)有机物 是重要的化工原料,其合成过程如下:
是重要的化工原料,其合成过程如下:

(1)化合物II的分子式为 ,Ⅳ中含氧官能团的名称是 ,反应①的反应类型是 反应。
(2)化合物I~IV具有的性质正确的是 。
A.1mol化合物II最多能与2molH2发生加成反应
B.1mol化合物II燃烧最多消耗8.5molO2
C.1mol化合物IV能与2mol金属钠、1molNaHCO3反应产生气体
D.化合物I和IV在一定条件下都能与乙酸发生酯化反应
(3)芳香化合物V是II的一种无甲基同分异构体,能使FeCl3溶液显紫色,则V的结构简式为 、 、 。
(4)一定条件下,化合物Ⅳ能形成缩聚高分子,该有机高分子的结构简式为 。
(5)有机物VI( )与
)与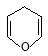 发生反应的方程式为 。
发生反应的方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省深圳市高三第一次调研考试理综化学试卷(解析版) 题型:选择题
(16分)工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
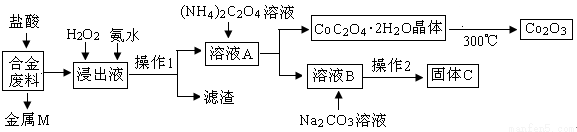
(1)金属M为 ,操作1为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)充分焙烧的化学方程式为 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是 ,90℃时Ksp(Li2CO3)的值为 。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省深圳市高三第一次调研考试理综化学试卷(解析版) 题型:选择题
下列离子方程式错误的是
A.石灰石和盐酸反应制CO2:CaCO3 + 2H+ = CO2↑+ Ca2+ +H2O
B.稀Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-= 3Fe3++NO↑+2H2O
C.Ca(ClO)2 溶液中通入过量的SO2:C1O-+ SO2 + H2O = HClO + HSO3-
D.铜溶于FeCl3溶液中:Cu + 2Fe3+ =2 Fe2+ + Cu2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市昌平区高二上学期期末考试化学试卷(解析版) 题型:推断题
(9分)叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成。

(1)甲中显酸性的官能团是 (填名称)。
(2)下列关于乙的说法,正确的是 (填名称)。
a.分子中碳原子和氮原子的个数比是7∶5
b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应
d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为 。
a.含有H2N-CH-COOH
b.在稀硫酸中水解有乙酸生成
(4)甲可以通过下列路线合成(分离方法和其他产物已经略去):
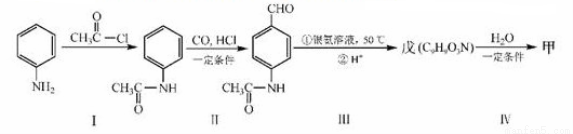
①步骤Ⅰ的反应类型是 。
②步骤Ⅰ和Ⅳ在合成甲过程中的目的是 。
③步骤反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015天津市和平区高一上学期期末考试化学试卷(解析版) 题型:选择题
向含有下列离子的溶液中,通入适量的氯气会引起离子浓度减少的是
①HCO3- ②SO32- ③OH- ④Fe2+
A.①② B.③④ C.①②③ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com