
| A. | 9.6g | B. | 6g | C. | 4.8g | D. | 2.4g |
分析 先根据第一份中发生的反应2Al+2NaOH+2H2O═2NaAlO2+3H2↑计算出铝的物质的量,再根据第二份中发生反应2Al+6HCl═2AlCl3+3H2↑、Mg+2HCl═MgCl2+H2↑计算出每份混合物中镁的物质的量,再计算出原合金中镁的总物质的量及质量.
解答 解:第一份中气体的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,
设铝的物质的量为x,则
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
x 0.3mol
则:3x=0.3mol×2,
解得:x=0.2mol,
第二份中气体的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
设每份合金中镁的物质的量为y,
2Al+6HCl═2AlCl3+3H2↑
2 3
0.2mol 0.3mol
Mg+2HCl═MgCl2+H2↑
1 1
y (0.5mol-0.3mol)=0.2mol
y×1=1×0.2mol,
解得:y=0.2mol,即:每份混合物中含有0.2molMg,则每份合金中含有镁的质量为:24g/mol×0.2mol=4.8g,
所以原合金中含有镁的质量为:4.8g×2=9.6g,
故选A.
点评 本题考查混合物反应的计算,题目难度中等,明确镁、铝的化学性质为解答关键,需要明确本题求算的是原混合物中镁的总质量,而计算过程中的数据是分成两等份的,为易错点.


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
| A | B | |
| C | D |
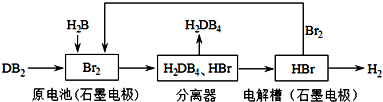
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使它转化为较稳定物质,便于保存和运输 | |
| B. | 增强漂白和消毒作用 | |
| C. | 使转化为较易溶于水的物质 | |
| D. | 增加氯的质量分数,有利于漂白、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
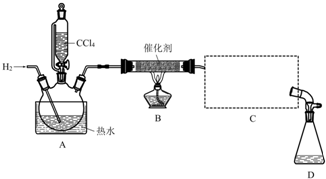
| 物质 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻-二溴苯只有一种 | |
| B. | 苯分子中所有原子在同一平面上 | |
| C. | 二甲苯没有同分异构体 | |
| D. | 苯既能发生加成反应也能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32g O2和O3的混合气体所含原子数为2NA | |
| B. | 100 mL 1 mol•L-1K2SO4溶液中含有的钾离子数为0.1NA | |
| C. | 10克氖气所含原子数约为6.02×1023 | |
| D. | 常温常压下,NA个H2分子的体积小于22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
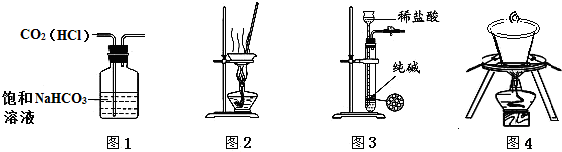
| A. | 用图1所示装置除去CO2中含有的少量HCl | |
| B. | 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| C. | 用图3所示装置制取少量纯净的CO2气体 | |
| D. | 用图4所示装置高温煅烧石灰石 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com