
【题目】NiSO4![]() 6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
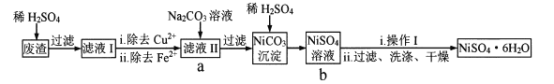
A. 溶解废渣时不能用稀盐酸代替稀H2SO4B. 除去Cu2+可采用FeS
C. 流程中a-b的目的是富集NiSO4D. “操作I”为蒸发浓缩、冷却结晶
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:

实验室用干燥而纯浄的二氧化硫和氯气合成硫酰氯,反应的热化学方程式为:SO2(g)+Cl2(g)![]() SO2Cl2(l) △H=-97.3 kJ· mol-1
SO2Cl2(l) △H=-97.3 kJ· mol-1
反应装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器B的名称为________;
(2)仪器A的作用是_______;
(3)装置乙中盛放的试剂为______,在实验室用氢氧化钠溶液吸收多余硫酰氯的离子反应方程式为______;
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_______(填序号);
①先通冷凝水,再通气体 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①分解产物中分离出硫酰氯的实验操作名称为____。
②某同学为检验硫酰氯产品中是否混有硫酸设计实验如下:取少量产品溶于水,加入盐酸酸化的氯化钡溶液,振荡,观察到有白色沉淀生成,则认为产品中含有硫酸。该同学的结论是否正确,请说明理由____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应 aA(气)![]() bB(气)达平衡后,保持温度不变,将容器体积减小1/2,当达到新的平衡时,B的浓度是原来的1.5倍,则
bB(气)达平衡后,保持温度不变,将容器体积减小1/2,当达到新的平衡时,B的浓度是原来的1.5倍,则
A. 平衡向逆反应方向移动 B. 物质A的转化率增大
C. 物质B的质量分数增加 D. a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠( Na2MoO4)可与重金属盐产生沉淀,是目前应用较多的一种新型水处理剂。利用精钼矿(主要成分是MoS2,含少量PbS等)来制取钼酸钠晶体的工艺流程如下图所示。

请回答下列问题:
(1)混合气A中含有一种大气污染物,其化学式为___________。
(2)焙烧的过程中采用如图1所示的“多层逆流焙烧”。

①多层逆流焙烧的优点是___________(任答两点)。
②依据如图2,写出第6~12层MoO2参加反应的化学方程式___________。
(3)写出碱浸时发生反应的离子方程式___________。
(4)PbS与H2O2反应时,温度高于40℃后,反应速率反而减慢,原因是___________。
(5)流程图中“除SO42-”的过程中,当 BaMoO4开始沉淀时,SO42-的去除率为97.0%,已知原 Na2MoO4溶液中c(MoO42-)=0.48mol/L, c(SO42-)=0.040mol/L, Ksp(BaSO4)=1.0×10-10, 则Ksp(BaMoO4)=___________。(过程中溶液体积变化忽略不计)
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n,则电池放电时的正极反应式是___________。
Lix(MoS2)n,则电池放电时的正极反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一一选修5:有机化学基础]
有机化合物K是有机合成中的一种重要的中间体,K的合成路线如下(部分产物及条件略去):

已知:
(1)A的核磁共振氢谱只有一组峰,A中官能团的名称为___________。
(2)B→C和(D+H)→K的反应类型分别是___________、___________。
(3)H的结构简式为___________。
(4)D的系统命名为___________。
(5)G→I的第①步反应方程式为___________;I→J的反应方程式为___________。
(6)同时满足下列条件的K的同分异构体有___________种(不考虑立体异构,也不包括K)。
①与K具有相同的官能团 ②分子中有一个甲基 ③具有六元碳环结构
(7)参照上述合成路线,设计一条由乙醛和乙炔为原料制备![]() 的合成路线(无机试剂任选):
的合成路线(无机试剂任选):![]() ___________。
___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是重要的化工原料,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解
(1)制备无水氯化铁

①仪器X的名称为____。
②装置的连接顺序为a→____→i,k→____(按气流方向,用小写字母表示)。
③实验结束后,取少量F中的固体加水溶解,经检测发现溶液中含有Fe2+,其原因为____。
(2)探究FeCl3与SO2的反应
已知反应体系中存在下列两种化学变化:
(i) Fe3+与SO2发生络合反应生成Fe(SO2)62+(红棕色);
(ii) Fe3+与SO2发生氧化还原反应,其离子方程式为①____

②_________
③_________
④实验结论:反应(i)、(ii)的活化能大小关系是:E(i)____E(ii)(填“>”、 “<”或“=”,下同),平衡常数大小关系是:K(i)__________K(ii)。
⑤另取5 mL l mol![]() L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施是____。
L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,将H2和I2各1 mol的气态混合物充入1 L的密闭容器中,发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH<0; 5 min后达到平衡状态,测得c(H2)=0.9 mol·L-1,则下列结论中,不能成立的是
2HI(g) ΔH<0; 5 min后达到平衡状态,测得c(H2)=0.9 mol·L-1,则下列结论中,不能成立的是
A. 平衡时H2、I2的转化率相等
B. 若将容器温度提高,其平衡常数K一定增大
C. 其他条件不变再向容器中充入少量H2,I2的转化率提高
D. 从反应开始至平衡的过程中,v(HI)=0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)![]() bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则错误的是( )
bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则错误的是( )
A. 平衡向正反应方向移动了 B. 物质A的转化率增大了
C. 物质B的质量分数增加了 D. a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下:①0.3mol氨气 ②6.02×1022个CO2分子 ③7.3gHCl ④0.2molCH4。体积最大的是___;密度最大的是___;质量最大的是___。(填序号)
(2)相同质量的SO2与SO3,其物质的量之比为___,氧元素的质量之比为___,原子总数之比为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com