
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-,横坐标表示加入NaOH的体积)。根据图示判断,下列说法正确的是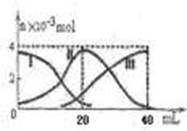
| A.当V(NaOH)=40mL时,c (Na+)+ c(H+)="2" c(A2-)+c(OH-) |
| B.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| C.滴加过程中当溶液呈中性时,V(NaOH)<20mL |
| D.HA-的电离程度小于水解程度 |
B
解析试题分析:A.根据电荷守恒可得,c (Na+)+ c(H+)="2" c(A2-)+c(OH-)+c(HA-)。错误。B.当V(NaOH)=20mL时,二者恰好发生反应:H2A+NaOH=NaHA+H2O,由于HA-会发生电离作用,c(Na+)>c(HA-),在溶液中除了HA-电离会产生H+外,水也会电离产生H+,所以c(H+)>c(A2-);但是弱电解质的电离远远小于盐的电离,所以c(HA-)>c(H+)。因此在溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。正确。C.由于当二者按照1:1混合时得到的溶液为NaHA,溶液显酸性,所以滴加过程中当溶液呈中性时,NaOH溶液的体积要大于20ml。即V(NaOH)>20mL。错误。D.根据图像可知在NaHA的溶液显酸性,说明HA-电离程度大于水解程度。错误。
考点:考查弱酸的酸式盐与碱反应时离子浓度的大小比较及溶液的酸碱性的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
室温下,对pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,其中叙述正确的是
| A.温度升高20℃后,两溶液pH均不变 |
| B.加适量的醋酸钠晶体后,两溶液的pH均增大 |
| C.加水稀释2倍后,两溶液的pH同等程度减小 |
| D.加足量的锌充分反应后,两溶液中产生的氢气一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各项说法中,不正确的是 ( )
| A.甲是向溴水通入SO2气体时,pH与SO2物质的量的关系图 |
| B.乙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图 |
| C.常温常压下,将2b mol CO2气体通入1L bmol·L-1的NaOH溶液中,随着CO2气体的通入,溶液中由水电离出的c(H+)有如丙图变化关系 |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)>c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在不同温度下,水溶液中c( )与c(
)与c( )有如图所示关系,下列有关说法正确的是
)有如图所示关系,下列有关说法正确的是
| A.c点对应的溶液中大量存在的离子可能为:Na+、Al3+、Cl-、CO32- |
| B.将25℃时的NaCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 |
| C.t℃>25℃ |
| D.ac线上的任意一点均有pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是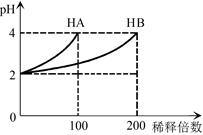
A.HB的电离方程式为HB=H++B-
B.稀释前,c(HB) > c(HA)=0.01 mol·L-1
C.NaA的水溶液中,离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+)
D.NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述不正确的是
| A.在稀盐酸中 c(H+)=c(Cl—)+c(OH—) |
B.常温下,在0.1mol/L的HNO3溶液中由水电离出的c(H+)<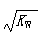 |
| C.将Na2CO3水溶液加热、蒸干,最后得到NaOH固体 |
| D.酸与碱完全中和,所得溶液的pH可能大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是
| A.pH=1和pH=2的盐酸,c(H+)之比为1:2 |
| B.物质A三态间的转化如下:A(g)→A(1)→A(s),则该转化过程中△S<O |
| C.pH=13的强碱溶液,加水稀释后,溶液中所有离子的浓度均变小 |
| D.pH=9的CH3COONa溶液和pH=9的NH3.H2O溶液,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述中正确的是 ( )
| A.明矾、硫酸铁都可以用于净水,但净水原理不同 |
| B.粗铝做阳极,硫酸铝溶液做电解液,电解精炼铝 |
| C.工业制硫酸中,将黄铁矿粉碎是为了提高黄铁矿的平衡转化率 |
| D.含有最高价元素的化合物,不一定有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.0.18mol·L-1的醋酸加水稀释,c(H+)/c(OH-)减小 |
| B.体积相同、pH相同的醋酸和盐酸完全溶解等量的镁粉,后者用时少 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大(不考虑温度变化) |
| D.V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com