
| A. | “NO2球”浸泡在冷水中,颜色变浅:2 NO2(g)?N2O4(g)△H<0 | |
| B. | 在反应FeCl3+3KSCN?Fe(SCN)3+3KCl 达平衡后,加入少量KCl固体,平衡逆向移动 | |
| C. | 在两支盛有双氧水的试管中,一支加入FeCl3溶液,反应明显加快,而另一支中加入CuSO4溶液,反应加快但不明显,说明催化剂具有较强选择性 | |
| D. | 用MnO2做催化剂,催化双氧水的分解,是因为MnO2可降低该反应活化能,提高活化分子的百分数 |
分析 A.颜色变浅,则平衡向着正向移动,据此判断焓变;
B.加入少量的KCl固体,对参加反应的离子的浓度无影响;
C.一支加入FeCl3溶液,反应明显加快,说明氯化铁对反应有催化作用,而另一支中加入CuSO4溶液,现象不明显,说明硫酸铜无催化作用;
D.加入催化剂,降低反应的活化能,使反应物中活化分子数和活化分子百分数同时增大,反应速率加快.
解答 解:A.“NO2球”浸泡在冷水中,颜色变浅,说明降低温度平衡向着正向移动,则正反应为放热反应,即:2 NO2(g)?N2O4(g)△H<0,故A正确;
B.加入少量的KCl固体,对参加反应的离子的浓度无影响,平衡不移动,故B错误;
C.一支加入FeCl3溶液,反应明显加快,说明氯化铁对反应有催化作用,而另一支中加入CuSO4溶液,现象不明显,说明硫酸铜无催化作用,可说明催化剂具有较强选择性,故C正确;
D.催化剂能降低反应的活化能,使反应物中活化分子数和活化分子百分数同时增大,分子运动速度加快,有效碰撞次数增多,反应速率加快,故D正确;
故选B.
点评 本题考查较为综合,涉及反应速率的实验探究以及外界条件对平衡移动的影响,题目难度不大,明确化学反应速率的影响因素为解答关键,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应时,生成0.1mol氧气,转移电子数为0.2NA | |
| B. | 2L 0.5mol•L-1亚硫酸溶液中,含有的H+离子数为2NA | |
| C. | 常温常压下,1mol氦气含有的原子数为2NA | |
| D. | 标准状况下,11.2L水含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,取适量的碳酸钠溶液,向其中逐滴滴加盐酸,生成的CO2的物质的量与滴加盐酸的体积关系如图所示,其中b=2a.下列说法正确的是( )
常温下,取适量的碳酸钠溶液,向其中逐滴滴加盐酸,生成的CO2的物质的量与滴加盐酸的体积关系如图所示,其中b=2a.下列说法正确的是( )| A. | 点o溶液、点b溶液、点d溶液的pH都大于7 | |
| B. | 点b溶液中:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-) | |
| C. | 点o溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3) | |
| D. | 点a溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热用△H3表示,则△H3<△H1 | |
| B. | 碳的燃烧热用△H3表示,则△H3>△H1 | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热值为57.3kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量57.3KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维和计算机芯片的材料都是二氧化硅 | |
| B. | 蛋白质只含C、H、O、N四种元素 | |
| C. | 可用酸性高锰酸钾溶液除去乙烷中的乙烯 | |
| D. | 液溴易挥发,在存放液溴的试剂瓶中应加水“液封” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
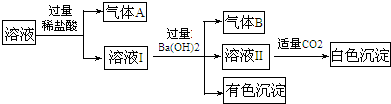
| A. | 气体B一定是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Al3+、Fe2+、NH4+、NO3- | |
| D. | 溶液中一定不存在大量的Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com