
| A. | 电解精炼铜的过程中,若阳极有64g铜放电溶解,则理论上电路中转移的电子数为2NA | |
| B. | 7.8g Na2O2与Na2S的混合物中含有的阴、阳离子的总数为0.3NA | |
| C. | 0.1 mol/LNa2CO3溶液中所含阴离子的总数大于0.1NA | |
| D. | 标准状况下22.4L三氯甲烷含有氯原子的数目是3NA |
分析 A、在电解精炼铜时,阳极上放电的是粗铜,而粗铜中含有比铜活泼的金属;
B、Na2O2与Na2S的摩尔质量均为78g/mol,且两者均由2个阳离子和1个阴离子构成;
C、溶液体积不明确;
D、标况下三氯甲烷为液态.
解答 解:A、在电解精炼铜时,阳极上放电的是粗铜,而粗铜中含有比铜活泼的金属也会放电,故当阳极上有64g铜放电时,转移的电子数多于2NA个,故A错误;
B、Na2O2与Na2S的摩尔质量均为78g/mol,故7.8g混合物的物质的量为0.1mol,且两者均由2个阳离子和1个阴离子构成,故0.1mol混合物中含0.3NA个离子,故B正确;
C、溶液体积不明确,故溶液中的阴离子的个数无法计算,故C错误;
D、标况下三氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量和含有的氯原子个数,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:解答题
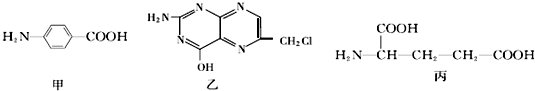
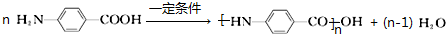
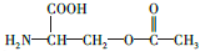 .
.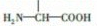 片段
片段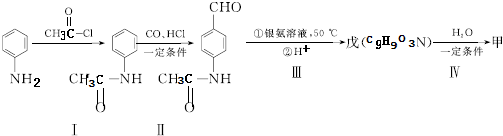
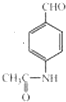 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$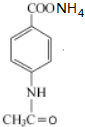 +3NH3+2Ag+H2O.
+3NH3+2Ag+H2O.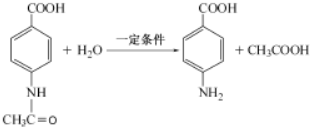 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$ mol的H35Cl分子所含中子数约为6.02×1023 | |
| C. | 3.5 g的35Cl2气体的体积为2.24 L | |
| D. | 35Cl2气体的摩尔质量为70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,分子中非金属元素电负性由大到小的顺序为O、N、C、H.
,分子中非金属元素电负性由大到小的顺序为O、N、C、H.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用纯碱溶液清洗餐具上油污 | B. | 用稀硫酸清洗水壶里水垢 | ||
| C. | 用漂白液洗涤白衬衣上红色墨迹 | D. | 用汽油清洗皮肤上的油漆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

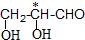 标有*号的碳原子(与其直接相连的4个原子或者原子团互不相同)为手性碳原子,由此把具有手性碳原子的分子称为手性分子.手性分子通常有两种构型,在生理活性等方面有很大的差别.请问青蒿素分子E中共有7个手性碳原子.
标有*号的碳原子(与其直接相连的4个原子或者原子团互不相同)为手性碳原子,由此把具有手性碳原子的分子称为手性分子.手性分子通常有两种构型,在生理活性等方面有很大的差别.请问青蒿素分子E中共有7个手性碳原子.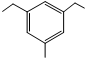 结构.有4种;写出其中一种的结构简式
结构.有4种;写出其中一种的结构简式 任意一种.
任意一种.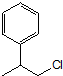 为原料合成
为原料合成 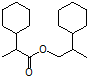 ,写出其合成路线(指明所用试剂和反应条件).
,写出其合成路线(指明所用试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害 | |
| C. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| D. | 汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9 g超重水(3H216O)含中子数为6NA | |
| B. | 标准状况下,22.4 L CCl4含有的分子数目为NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com