
| A. | 属于金属元素 | B. | 中子数与质子数之差为29 | ||
| C. | 原子的核外电子数为13 | D. | 27Al和42Al是两种不同的核素 |
分析 先根据Al的电子排布判断元素在周期表中的位置;判断A根据质子数、中子数、质量数之间的关系,判断B根据原子的质子数与电子数的关系,判断C根据同位素的定义判断D.
解答 解析:Al元素为13号元素,根据构造原理,核外电子排布式1S22S22P63S23P1,字母前的数字表示电子层数,所以Al属第三周期第ⅢA族.
A.铝是金属元素,故A正确;
B.质子数+中子数=质量数,中子数与质子数之差=(质量数-质子数)-质子数=(42-13)-13=16,故B错误;
C.原子的核外电子数等于核内质子数,所以核外有13个电子,故C正确;
D.27Al和42Al是质子数相同中子数不同的同一元素,所以是不同的两种核素,故D正确.
故选B.
点评 本题考查的是有关质子数、中子数、电子数之间的计算,以及同位素的定义,是小型综合题,侧重于基础知识的考查.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 醋可以作为防腐剂和调味剂 | B. | 味精可作调味剂 | ||
| C. | 甲醛是一种很好的食品防腐剂 | D. | 苯甲酸钠可用作食品添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③②④ | B. | ③②①④ | C. | ③①②④ | D. | ④③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 分子的下列叙述中,错误的是( )
分子的下列叙述中,错误的是( )| A. | 与苯环直接相连的原子都在同一平面上 | |
| B. | 分子中共有10个不饱和碳原子 | |
| C. | 最多有18个原子可能处在同一个平面上 | |
| D. | 分子式为C11H6ClF3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |  |  |
| ① | ② | ③ | ④ |
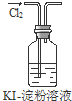
| A. | 实验①中溶液出现蓝色 | |
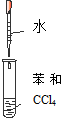
| B. | 实验②试管出现分层现象,上下为油层,中间为水层 | |
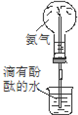
| C. | 实验③中烧瓶内溶液变红色 | |
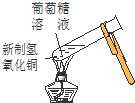
| D. | 实验④中出现砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| AlT/(mol•L-1) | Ala/% | Alb/% | A1c/% |
| 0.208 | 1.4 | 86.6 | 12.0 |
| 0.489 | 2.3 | 86.2 | 11.5 |
| 0.884 | 2.3 | 88.1 | 9.6 |
| 1.613 | 3.1 | 87.0 | 9.9 |
| 2.520 | 4.5 | 88.2 | 7.3 |
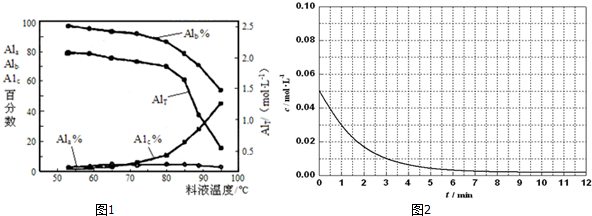
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量CO2通入Na2SiO3溶液:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| B. | 醋酸与NaOH溶液反应:H++OH-═H2O | |
| C. | 氧化镁溶于稀硫酸:MgO+2H+═H2O+Mg2+ | |
| D. | 向AlCl3溶液中加入过量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池可将热能直接转变为电能 | |
| B. | 铁制品上镀铜时,镀件为阳极,铜盐为电镀液 | |
| C. | 镀锌铁皮的镀层损坏后,铁更容易腐蚀 | |
| D. | 铅蓄电池充电时Pb极与外电源的负极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com