

| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

分析 废钒催化剂粉碎、水浸,将溶解性物质溶于水,然后过滤得到滤渣和滤液,根据溶解性表知,滤液中含有VOSO4,滤渣中含有V2O5等不溶性杂质,向滤渣中加入亚硫酸钠和稀硫酸,亚硫酸钠具有还原性,能将V2O5还原为VOSO4,然后过滤得到滤渣和滤液,将两部分滤液混合并加入氯酸钾,氯酸钾具有氧化性,能将VOSO4氧化为(VO2)2SO4,调节溶液pH为8且采用离子交换方法得到VO3-,向溶液中加入氯化铵,得到难溶性的NH4VO3,焙烧NH4VO3得到V2O5,
(1)工业由V2O5冶炼金属钒常用铝热剂法,铝和五氧化二钒在高温下发生置换反应生成V,根据反应物、生成物及反应条件书写方程式;
(2)VOSO4为可溶性物质;
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,铵根离子和VO3-反应生成难溶性的NH4VO3,根据图知,在80℃、氯化铵系数为4时沉降率最大;
(4)该反应中V元素化合价由+5价变为+4价、C元素化合价由+3价变为+4价,转移电子数为2,再结合原子守恒、电荷守恒配平方程式;
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极上VO2+失电子发生氧化反应.
解答 解:废钒催化剂粉碎、水浸,将溶解性物质溶于水,然后过滤得到滤渣和滤液,根据溶解性表知,滤液中含有VOSO4,滤渣中含有V2O5等不溶性杂质,向滤渣中加入亚硫酸钠和稀硫酸,亚硫酸钠具有还原性,能将V2O5还原为VOSO4,然后过滤得到滤渣和滤液,将两部分滤液混合并加入氯酸钾,氯酸钾具有氧化性,能将VOSO4氧化为(VO2)2SO4,调节溶液pH为8且采用离子交换方法得到VO3-,向溶液中加入氯化铵,得到难溶性的NH4VO3,焙烧NH4VO3得到V2O5,
(1)工业由V2O5冶炼金属钒常用铝热剂法,铝和五氧化二钒在高温下发生置换反应生成V,根据反应物、生成物及反应条件知,该反应方程式为3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V,故答案为:3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V;
(2)VOSO4为可溶性物质,所以溶液中的溶质为VOSO4,故答案为:VOSO4;
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,铵根离子和VO3-反应生成难溶性的NH4VO3,离子方程式为NH4++VO3-=NH4VO3↓,根据图知,在80℃、氯化铵系数为4时沉降率最大,故答案为:NH4++VO3-=NH4VO3↓;4;80℃;
(4)该反应中V元素化合价由+5价变为+4价、C元素化合价由+3价变为+4价,转移电子数为2,再结合原子守恒、电荷守恒配平方程式为2VO2++H2C2O4+2H+=2VO2++2CO2↑+2H2O,故答案为:2VO2++H2C2O4+2H+=2VO2++2CO2↑+2H2O;
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极上VO2+失电子发生氧化反应,电极反应式为VO2++H2O-e-=VO2++2H+,故答案为:VO2++H2O-e-=VO2++2H+.
点评 本题考查物质的分离和提纯,为高频考点,侧重考查氧化还原反应、离子反应方程式的书写、原电池和电解池原理等知识点,明确反应原理是解本题关键,知道流程图中发生的反应及实验基本操作,难点是电极反应式的书写,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2完全转化为SO3 | |
| B. | 消耗2 mol SO2的同时生成2 mol SO3 | |
| C. | SO2、O2与SO3的物质的量之比为2:1:2 | |
| D. | SO2、O2与SO3的浓度不再随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
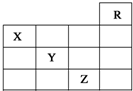 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )| A. | 只有③ | B. | 只有①④ | C. | 只有①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.

 ,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类 | B. | 脂肪 | C. | 维生素 | D. | 蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com