
 已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O△H<0
已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O△H<0分析 (1)平衡常数等于生成物浓度幂之积比上反应物浓度幂之积;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,也可根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
(3)根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解电解消耗OH-提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为4OH--4e-═O2↑+2H2O;
(4)根据盖斯定律分析解答.
解答 解:(1)平衡常数等于生成物浓度幂之积比上反应物浓度幂之积,所以K=$\frac{c(C{r}_{2}{O}_{7}^{2-})}{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}$,故答案为:K=$\frac{c(C{r}_{2}{O}_{7}^{2-})}{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}$; (2分)
(2)A、V正(CrO42-)=2V逆(Cr2O72-),速率之比等于对应物质的量之比,说明该反应已达平衡状态,故A正确;
B、溶液颜色不变说明各物质的浓度不变,该反应已达平衡状态,故B正确;
C、溶液中c(CrO42-):c(Cr2O72-)=2:1,但不是浓度不变的状态,故C错误;
D、升温该反应平衡常数变大,与是否平衡无关,故D错误;
E、向平衡后的体系中加入一定量的水,平衡不移动,是平衡的移动,与平衡状态无关,故E错误;
故选AB;
(3)根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解消耗OH-,提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为4OH--4e-═O2↑+2H2O,故答案为:正;4OH--4e-═O2↑+2H2O;
(4)①H+(aq)+OH-(aq)=H2O(l);△H=-a KJ/mol;
②3Cl2(g)+2Cr3+(aq)+16OH-(aq)=2CrO42-(aq)+6Cl-(aq)+8H2O(l);△H=-b KJ/mol;
③2CrO42-(aq)+2H+(aq)?Cr2O72-(aq)+H2O(l);△H=-c KJ/mol;
根据盖斯定律:16①-②-③得:Cr2O72-(aq)+6Cl-(aq)+14H+(aq)=3Cl2(g)+2Cr3(aq)++7H2O(l)△H=(c+b-16a)KJ/mol,故答案为:Cr2O72-(aq)+6Cl-(aq)+14H+(aq)=3Cl2(g)+2Cr3(aq)++7H2O(l)△H=(c+b-16a)KJ/mol.
点评 本题考查原电池设计、盖斯定律知识点、化学平衡状态,会正确书写电极反应式,为高考高频点.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2SO3已部分氧化 | |
| B. | 加入硝酸钡溶液生成的沉淀一定含BaSO4 | |
| C. | 加入硝酸后的沉淀一定含BaSO3 | |
| D. | 此实验不能确定Na2SO3是否部分氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
 是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60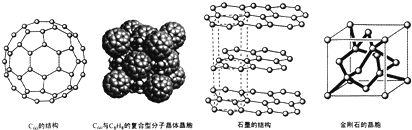
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| B. | 向次氯酸钙溶液通入SO2:Ca2++2C1O-+H2O+SO2═CaSO3↓+2HC1O | |
| C. | 氢氧化钙溶液气碳酸氢镁溶液反应:Ca2++OH-+HCO3 -═CaCO3↓+H2O | |
| D. | 硫酸亚铁的酸性溶液中加入H2O2溶液:Fe 2++H2O2+2H+═Fe 3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的体积分数增大 | B. | 平衡向右移动 | C. | B的转化率提高 | D. | a+b<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将某有机物与溴的四氯化碳 溶液混合 | 溶液褪色 | 该有机物中必定含有 碳碳双键 |
| B | 向亚硫酸钠溶液中滴加硝酸 钡和稀硝酸 | 产生白色沉淀 | 亚硫酸钠溶液己变质 |
| C | 向酸性高锰酸钾溶液中滴加 双氧水 | 紫色褪去,产生气泡 | H202具有还原性 |
| D | 向油脂皂化反应后的溶液中 滴入酚酞 | 溶液不变红 | 油脂己经完全皂化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤及现象 | 实验结论(填离子符号) |
| 取废水样品观察,呈无色 | 废水中不含Cu2+、Fe3+ |
| 测所取废水样品的pH,pH=13 | 废水中含较多的OH- |
| 向废水样品中加入过量的稀盐酸,没有气泡产生 | 废水中不含CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com