
某有机物的结构简式为  ,1mol该有机物与足量的NaOH
,1mol该有机物与足量的NaOH 溶液在一定条件下充分反应,消耗的NaOH的物质的量为
溶液在一定条件下充分反应,消耗的NaOH的物质的量为
A.5 mol B.4 mol C.3 mol D.2 mol
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源:2017届重庆市西北狼教育联盟高三12月月考化学试卷(解析版) 题型:选择题
四种短周期元素W、R、P、Q的原子序数依次增大,W的一种核素没有中子,R、Q同主族,R元素原子的最外层电子数是内层电子数的3倍,P元素与R元素形成的常见化合物中既含离子键又含非极性共价键。下列说法不正确的是( )
A. Q元素形成的酸一定是强酸
B. P与R形成化合物中,阴、阳离子个数比一定为1:2
C. 原子半径:W<R<Q<P
D. 沸点:W2R>W2Q
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上12月月考化学卷(解析版) 题型:实验题
直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m (n>2,m≤10)的实验流程如下:

已知:盐基度= ×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产 品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
(1)实验加入硫酸的作用是____________,取样分析Fe2+浓度,其目的是___________。
(2)用pH试纸测定溶液pH的操作方法为____________,若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数____________(填“偏高”、“偏低”、“无影响”)
(3)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2]?[Fe2(OH)n(SO4)3-n/2]m,则水解反应的化学方程式为____________.
(4)产品盐基度的测定方法:
Ⅰ称取m g固体试样,置于400mL聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.
Ⅱ室温下放置10min,再加入10mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀.
Ⅲ加入5滴酚酞指示剂,立即用物质的量浓度为c mol•L-1的氢氧化钠标准液滴定至终点,消耗体积为VmL.
Ⅳ向聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0mL.
①达到滴定终点的现象为____________。
②已知试样中Fe3+的质量分数为a,则该试样的盐基度的计算表达式为________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上12月月考化学卷(解析版) 题型:选择题
我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”; ②“以曾青涂铁,铁赤色如铜”。下列有关叙述正确的是
A.①中水银“积变又还成丹砂”说明水银发生了还原反应
B.②中反应的离子方程式为:2Fe+3Cu2+=2Fe3++3Cu
C.根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒
D.水银能跟曾青发生置换反应生成单质铜
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上模拟四化学试卷(解析版) 题型:选择题
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32?、SO42?、NO3?中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是

A.溶液中一定不含CO32?,可能含有SO42?和NO3?
B.溶液中n(NH4+)=0.2mol
C.溶液中的阳离子只有H+、Mg2+、Al3+
D.n(H+)∶n(Al3+)∶n(Mg2+ ) = 1∶1∶1
) = 1∶1∶1
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三11月阶段测化学卷(解析版) 题型:选择题
如图电化学原理可用于治理水中硝酸盐的污染,下列说法不正确的是
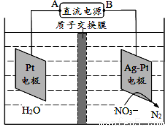
A.A为电源正极
B.在Pt电极上发生氧化反应
C.阴极电极反应式为NO3-+6H2O+10e-==N2+12OH‑
D.若电路转移10mol电子质子交换膜右侧溶液质量减少18g
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上周考五化学试卷(解析版) 题型:推断题
【化学—选修5:有机化学基础】
化合物H的分子中含有醛基和酯基,H可以用C和F在一定条件下合成(如图);
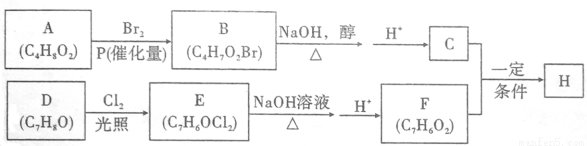
已知以下信息:
①A的核磁共振氢谱中有三组峰;且能与饱和碳酸氢钠溶液反应放出CO2。
②
③化合物D苯环上的一氯代物只有两种。
④通常同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)A的化学名称_____________________;(系统命名法)
(2)B的结构简式为_____________________;
(3)D生成E的化学方程式为_____________________,该反应类型为___________;
(4)F的结构简式为______________;
(5)H在一定条件下反应生成高聚物的化学方程式为______________;
(6)F的同系物G比F相对分子质量大14,G的同分异构体中能同时满足如下条件:①苯环上只有两个取代基;不能使FeCl3溶液显色,共有_______种(不考虑立体异构)。G的一个同分异构体被酸性高锰酸钾溶液氧化后核磁共振氢谱为两组峰,且峰面积比为2:1,写出G的这种同分异构体的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上五调考试化学卷(解析版) 题型:选择题
A、B、C、D、E是原子序数依次增大的五种短周期元素且B、C相邻,A元索可以与B、C、E元素分别形成甲、乙、丙三种物质且甲、乙均为10电子化合物,丙为18电子化合物。D元索的最外层电子数与核外电子层数相等。已知:甲+E2=丙+ Br2,甲+丙=丁,下列说法中正确的是( )
A. 离子半径:D>C>B
B. A与B两种元素共同形成的10电子粒子有3种
C. D元素在周期表中的位置是第二周期第ⅡA族
D. 丁物质均由非金属元索构成,只含共价键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:选择题
下列说法中错误的是
A.卤化氢中,HF的沸点最高,是由于HF分子间存在氢键
B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低
C.H2O的沸点比HF的沸点高,是由于水中氢键键能大
D.氨气极易溶于水与氨气分子和水分子间形成氢键有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com