
氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸中的哪种微粒(H2O、H+、SO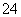 )能使氧化铜溶解。请你和他一起通过图中Ⅰ、Ⅱ、Ⅲ三个实验完成这次探究活动。
)能使氧化铜溶解。请你和他一起通过图中Ⅰ、Ⅱ、Ⅲ三个实验完成这次探究活动。
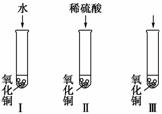
(1)你提出的假设是___________________________________________。
(2)通过实验Ⅰ可以证明_______________________________________________。
(3)要证明另外两种微粒能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅲ中应该加入____________。
(4)探究结果为______________________________________________。
你认为除实验Ⅱ所用试剂外,还能够溶解氧化铜的一种常见物质是____________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列各选项中所述的两个量,前者一定大于后者的是( )
A.将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量
B.pH=10的NaOH和Na2CO3溶液中,水的电离程度
C.相同温度下,10mL 0.1mol/L的醋酸与100mL 0.01mol/L的醋酸中H+的物质的量
D.物质的量浓度相等的(NH4)2SO4溶液与(NH4)2CO3溶液中NH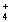 的物质的量浓度
的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
现有乙酸和链状单烯烃的混合物,若其中氧的质量分数为a ,则碳的质量分数是( )
A.3a/4 B.12 (1-a)/13 C.(1-a)/7 D.6(1-a)/7
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色透明溶液,跟金属铝反应放出H2,试判断下列离子:
Mg2+、Ba2+、Cu2+、H+、Ag+、SO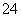 、SO
、SO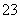 、OH-、HCO
、OH-、HCO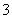 、NO
、NO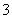 ,何种离子能大量存在于此溶液中。
,何种离子能大量存在于此溶液中。
(1)当生成Al3+时,可能存在_________________________________。
(2)当生成[Al(OH)4]-时,可能存在________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
纯铁的熔点为1 535 ℃,而高炉中炼铁时生铁(含碳量较高的铁的合金)在1 200 ℃左右就熔化了,这是因为( )
A.铁的纯度越高熔点越低
B.合金的熔点比其成分物质的熔点高
C.因为形成了铁碳合金,所以熔点变低
D.生铁在高炉内熔化的过程中发生了化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合硫酸铁(SPFS)是一种新型的饮用水处理剂和城市污水净化剂,其化学组成可表示为[Fe2(OH)n(SO4)3-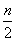 ]m。某研究小组将聚合硫酸铁在一定条件下加热完全分解,对所得气体产物和固体产物进行实验探究。请利用实验室常用仪器、用品和以下试剂完成验证和探究过程(已知SO3的熔点为16.8 ℃)。
]m。某研究小组将聚合硫酸铁在一定条件下加热完全分解,对所得气体产物和固体产物进行实验探究。请利用实验室常用仪器、用品和以下试剂完成验证和探究过程(已知SO3的熔点为16.8 ℃)。
试剂:1.0 mol·L-1的盐酸、1.0 mol·L-1的KMnO4溶液、0.1 mol·L-1的BaCl2溶液、20%的KSCN溶液、品红溶液、蒸馏水、冰水。
(1)聚合硫酸铁中铁元素的化合价是________。
(2)固体产物成分的探究
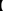 实验设计
实验设计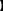
| 实验步骤 | 现象 |
| 步骤1:取适量的固体产物于试管中,加入足量1.0 mol·L-1的盐酸,充分振荡使固体完全溶解 | 固体溶解,没有观察到气泡,溶液呈黄色 |
| 步骤2:取少量步骤1所得溶液于试管中,加入适量20%的KSCN溶液,振荡 | 溶液呈血红色 |
| 步骤3:另取少量步骤1所得溶液于试管中,滴入少量1.0 mol·L-1的KMnO4溶液,振荡 | KMnO4的紫红色不褪去 |
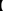 思考与判断
思考与判断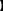
根据上面的信息,可以确定固体产物的成分是________;步骤1中发生反应的离子方程式为
______________________________________________________________。
(3)气体产物成分的探究(不考虑水蒸气)
 提出假设
提出假设
假设1:所得气体的成分是SO3;
假设2:所得气体的成分是SO2、O2;
假设3:所得气体的成分是________。
 设计实验方案,验证假设
设计实验方案,验证假设
按下表的实验步骤写出预期现象与结论。
| 实验操作 | 预期现象与结论 |
| 步骤1:将少量气体产物通入盛有适量品红溶液的试管中,观察溶液的颜色变化,然后加热再观察溶液的颜色变化 | ①若____________,则________成立 ②若____________,则________成立 |
| 步骤2:将气体产物缓缓通过浸在冰水中的U形
| 结合上述步骤1的有关结论__________(填①或②) ①若____________,则____成立 ②若____________,则____成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2 乙:MgO、NO2、O2 丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是_____________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
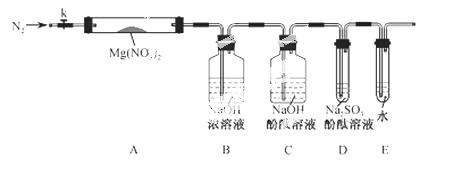
(2)实验过程
①取器连接后,放人固体试剂之前,关闭k,微热硬质玻璃管(A),观察到 E 中有气泡连续放出,表明________
E 中有气泡连续放出,表明________
②称取Mg(NO3)2固体3 .79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是________;关闭K,用酒精灯加热时,正确操作是先________然后固定在管中固体部位下加热。
③观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1 . 0g
⑤取少量剩余固体于试管中,加人适量水,未见明显现象。
(3)实验结果分析讨论
① 根据实验现象和剩余固体的质量经分析可初步确认猜想_______是正确的。
② 根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:_____________________(填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是_____________________。
③ 小组讨论后达成的共识是上述实验设计仍不完善,需改进装里进一步研究。
查看答案和解析>>
科目:高中化学 来源: 题型:
“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是 ①实验室收集氨气采用图所示装置 ②实验室中做氯气与钠的反应实验时采用图所示装置 ③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验 ④实验室中采用图所示装置进行铜与稀硝酸的反应( )
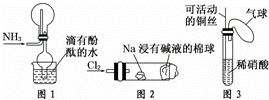
A.②③④ B. ①②③ C. ①②④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
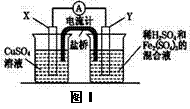 金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解。
金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解。
(1)写出铜溶于上述混合溶液的离子方程式 。
(2)若在如图Ⅰ所示的装置中发生(1)中的反应,则X极是
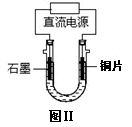 (“正极”或“负极”),电极反应式是
(“正极”或“负极”),电极反应式是
(3)铜完全溶解时,所得溶液中Fe3+、Cu2+、H+三种阳离子的浓
度均为0.2 mol/L(假设溶液体积不变),若用电解方法回收铜,
装置如图Ⅱ所示。
①电解开始阶段,阳极的电极反应式为 ,
阴极的电极反应式为 。
②判断溶液中的Cu2+已完全析出的现象是 。
当Cu2+恰好完全析出时,转移电子的物质的量 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com