
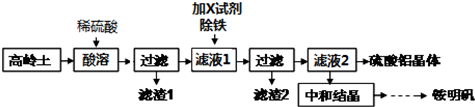
分析 高岭土用稀硫酸溶解,Al2O3、Fe2O3反应得到Al2(SO4)3、Fe2(SO4)3,SiO2不与硫酸反应,过滤得到滤渣1为SiO2,滤液中含有Al2(SO4)3、Fe2(SO4)3及剩余的硫酸,向滤液中加入物质除去Fe元素,然后过滤,则滤渣2为氢氧化铁,将滤液蒸发浓缩、冷却结晶和过滤得到硫酸铝晶体,用硫酸调节酸铝比(溶液中游离硫酸和硫酸铝的物质的量之比),再用氨水中和至一定的pH值即可析出铵明矾晶体,反应方程式为Al2(SO4)3+H2SO4+2NH3•H2O+22H2O=2[NH4Al(SO4)2•12H2O]↓或Al2(SO4)3+H2SO4+2NH3+24H2O=2[NH4Al(SO4)2•12H2O]↓,结合题目分析解答.
解答 解:(1)高岭土首先需要灼烧,实验室灼烧高岭土所需的实验仪器有盛放药品的仪器坩埚、泥三角、用于加热的仪器酒精灯、盛放泥三角的仪器三脚架,
故选:bdef;
(2)通过以上分析知,酸溶过程中Al2O3、Fe2O3与稀硫酸反应得到Al2(SO4)3、Fe2(SO4)3,离子方程式为Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O;
(3)铁离子能和KSCN溶液反应生成血红色溶液,所以要检验除铁后的滤液中是否含有Fe3+,应采取的实验方法为取少量除铁后的滤液于试管中,滴加几滴KSCN溶液,若溶液变为血红色则含Fe3+,否则不含Fe3+;滤渣2的主要成分为Fe(OH)3,
故答案为:取少量除铁后的滤液于试管中,滴加几滴KSCN溶液,若溶液变为血红色则含Fe3+,否则不含Fe3+;Fe(OH)3;
(4)滤液2→硫酸铝晶体操作包含的实验步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发浓缩;冷却结晶;过滤;
(5)通过以上分析知,该过程中的总反应方程式Al2(SO4)3+H2SO4+2NH3•H2O+22H2O=2[NH4Al(SO4)2•12H2O]↓或Al2(SO4)3+H2SO4+2NH3+24H2O=2[NH4Al(SO4)2•12H2O]↓,
故答案为:Al2(SO4)3+H2SO4+2NH3•H2O+22H2O=2[NH4Al(SO4)2•12H2O]↓或Al2(SO4)3+H2SO4+2NH3+24H2O=2[NH4Al(SO4)2•12H2O]↓.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生分析能力、实验基本操作能力等,明确流程图中发生的反应及基本操作方法、物质性质是解本题关键,知道常见仪器用途,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
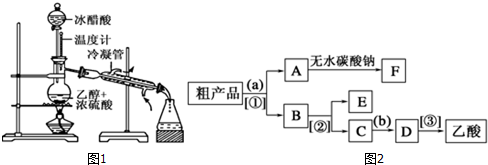
 苯甲酸乙酯是一种无色透明液体、能与乙醇、乙醚混溶,不溶于水.用于配制香水香精和人造精油,其制备原理如下:
苯甲酸乙酯是一种无色透明液体、能与乙醇、乙醚混溶,不溶于水.用于配制香水香精和人造精油,其制备原理如下: +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O| 物质 | 颜色状态 | 密度/g•cm-3 | 熔点/℃ | 沸点/℃ |
| 苯甲酸* | 白色固体 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 无色液体 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 无色液体 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 无色液体 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 无色液体 | 0.713 | -116.3 | 34.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
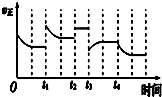 合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,在反应过程中,正反应速率的变化如图下列说法正确的是( )
合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,在反应过程中,正反应速率的变化如图下列说法正确的是( )| A. | t1时增大了压强 | B. | t2时充入了稀有气体 | ||
| C. | t3时升高了温度 | D. | t4时降低了温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
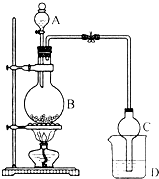 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低体系温度能加快该反应的速率 | |
| B. | 0~2S内用O2表示该反应的平均反应速率为0.15mol/(L•s) | |
| C. | 增大SO3的浓度能减慢该反应速率 | |
| D. | 反应一段时间后可生成4molSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
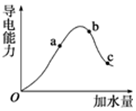 一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答.
一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
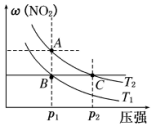 反应 N2O4(g)?2NO2(g)在温度为 T1、T2(T2>T1)时,平衡体系中 NO2的体积分数随压强变化如图所示.下列说法正 确的是( )
反应 N2O4(g)?2NO2(g)在温度为 T1、T2(T2>T1)时,平衡体系中 NO2的体积分数随压强变化如图所示.下列说法正 确的是( )| A. | 由图可知 B 点的平衡常数大于 C 点的平衡常数 | |
| B. | A、C 两点气体的颜色:A 深,C 浅 | |
| C. | A、C 两点气体的平均相对分子质量:A<C | |
| D. | 保持容器体积不变,再充入 N2O4 气体,平衡逆向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com