
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | ______ | ______ |
 CuSO4+2H2O+SO2↑,
CuSO4+2H2O+SO2↑, CuSO4+2H2O+SO2↑;KMnO4溶液;
CuSO4+2H2O+SO2↑;KMnO4溶液;

科目:高中化学 来源: 题型:
| ||
| ||
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | BaSO4 BaSO4 |
BaSO3 BaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
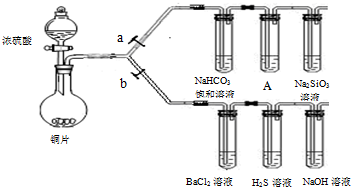
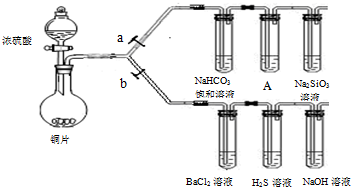
科目:高中化学 来源:2011-2012年重庆西南大学附中高一下学期期中考试化学试卷(解析版) 题型:实验题
根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)

(1)验证碳、硅非金属性的相对强弱。(巳知酸性:亚硫酸 >碳酸)
①接仪器并_________________、加药品后,打开a关闭 b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是: 。
装置A中的试剂可以是: 。
③能说明碳的非金属性比硅强的实验现象是: 。
(2)验证 SO2的氧化性、还原性和酸性氧化物的通性。
①打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是:
③BaCl2溶液中无明显现象,将其分成两份,分別滴加下列溶液,将产生的沉淀的化学式填人下表相应位置:

写出SO2与氯水反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年安徽省高一下学期期中质检化学试卷(解析版) 题型:实验题
实验探究:探究碳、硅元素的非金属性的相对强弱
根据要求完成下列各小题
(1)实验装置:

填写所示仪器名称A B
(2)实验步骤:
连接仪器、_____________、加药品后,打开a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是 ;
装置E中足量酸性KMnO4溶液的作用是 ;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是 ;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___(填“能”或“否”),试管D中发生反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com