
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为________________________。
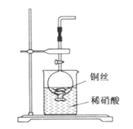 (2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图所示。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是
(用化学方程式表示)。
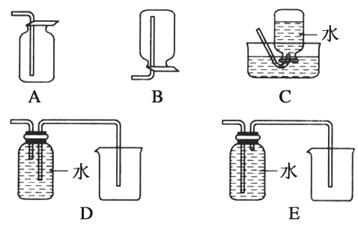
(3)以下收集NO气体的装置,合理的是________(填选项代号)。
(4)假设实验中12.8 g Cu全部溶解,需要通入标况下________L O2才能使NO全部溶于水。
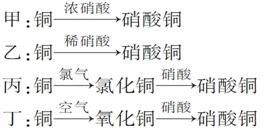
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”)。
 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一: 甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |
该同学的实验目的是研究_____________对反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持__________相同。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1) 针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想反应速率明显加快的原因还可能是_________ _。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还需要选择的试剂最合理的是 (选填编号)。
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化中,吸收的热量用于克服分子间作用力的是( )
A.液氨受热蒸发 B.加热碘化氢气体使之分解
C.加热氯化钠晶体使之熔化 D.HCl气体溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关聚乙烯的说法正确的是( )
A.聚乙烯是通过加聚反应生成的
B.聚乙烯具有固定的元素组成,因而具有固定的熔、沸点
C.聚乙烯塑料袋因有毒,不可以装食品
D.聚乙烯因性质稳定,故不易造成污染
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是 ( )
A.双原子单质分子中的共价健一定是非极性键
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.含有共价键的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物; B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1) X在周期表中的位置是_____________________________。
(2) 化合物Y2X2的电子式为 ;它含有的化学键类型有 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3) A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_____________________________________。
(4) A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为_____________________________。
(5) 写出化合物Y2X2与水反应的离子方程式____________________________。
(6) B的最高价氧化物的结构式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是( )
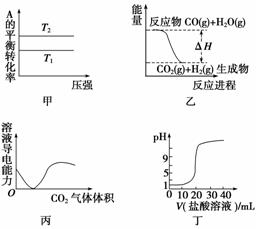
A.由图甲可以判断:若T1>T2,反应A(g)+B(g)2C(g)的ΔH<0
B.图乙表示可逆反应CO(g)+H2O(g)CO2(g)+H2(g) ΔH>0
C.图丙表示CO2通入饱和Na2CO3溶液中,溶液中导电性变化
D.图丁表示0.1 mol·L-1的盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液pH随加入盐酸体积的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com