
| A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
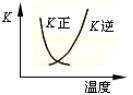
B.2SO2(g) + O2(g) 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示 |
C.2NO+2CO 2CO2+N2的ΔH<0,常温下该反应一定能自发进行 2CO2+N2的ΔH<0,常温下该反应一定能自发进行 |
| D.25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 |
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④ | C.①④⑤ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl-、Br-、CrO42- | B.CrO42-、Br-、Cl- | C.Br-、Cl-、CrO42- | D.Br-、CrO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
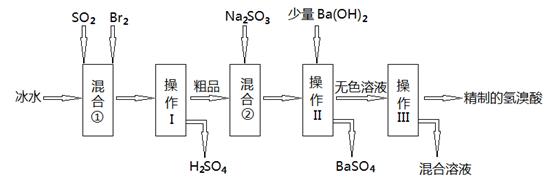
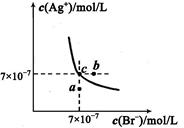
| A.向含有Cl-和Br- 的混合液中滴加硝酸银溶液,一定先产生AgBr的沉淀 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数Κ≈816 AgBr(s)+Cl-(aq)平衡常数Κ≈816 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
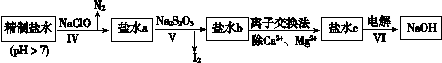
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.c(Ba2+)=c(SO )=(Ksp) )=(Ksp)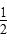 |
B.c(Ba2+)·c(SO )=Ksp,c(Ba2+)>c(SO )=Ksp,c(Ba2+)>c(SO ) ) |
C.c(Ba2+)·c(SO )>Ksp,c(Ba2+)=c(SO )>Ksp,c(Ba2+)=c(SO ) ) |
D.c(Ba2+)·c(SO )≠Ksp,c(Ba2+)<c(SO )≠Ksp,c(Ba2+)<c(SO ) ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com