
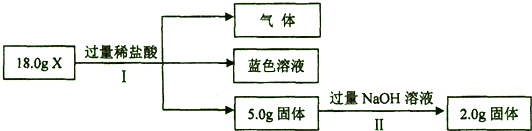
| 4.8g |
| 64g/mol |
| 2 |
| 3 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、ICl3与水反应的产物为HI和HClO |
| B、ICl3与KI反应时,氯元素被还原 |
| C、ICl与冷NaOH溶液反应的离子方程式为:ICl+2OH-=IO-+Cl-+H2O |
| D、ICl与水的反应属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol/L |
| B、pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| C、pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-) |
| D、pH相同的①CH3COONa、②NaHCO3两种溶液的c(Na+):①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
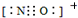
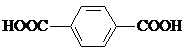 )、4,4′-联吡啶
)、4,4′-联吡啶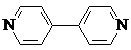 (可简化为
(可简化为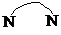 )等与Ni2+能形成多核配合物.配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如图2:
)等与Ni2+能形成多核配合物.配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如图2: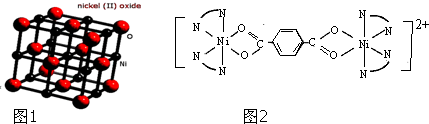
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.68 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.1gCl2与5.6gFe反应,转移的电子总数为0.3NA |
| B、实验室中用含4molHCl的浓盐酸跟足量MnO2加热反应可制得Cl2的分子数为NA |
| C、1 mol OH-和1 mol-OH (羟基)中含有的质子数均为9NA |
| D、标准状况下,22.4mLH2O约含有 3.73NA个原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com