
| A. | 质量相同时,分子数相同 | B. | 同温同压下,密度相同 | ||
| C. | 体积相同时,分子数相同 | D. | 质量相等时,原子数相同 |
分析 A.质量相等,但M不同,则物质的量不同;
B.依据PV=$\frac{m}{M}$RT,得到PM=$\frac{m}{V}$RT=ρRT分析;
C.体积相同,温度压强不知不能确定气体所含气体分子数;
D.质量相同,最简式均为CH2,则CH2的物质的量相同.
解答 解:A.质量相等,但C2H4和C3H6两种气体的摩尔质量M不同,则气体物质的量不同,所含分子数不同,故A错误;
B.依据PV=$\frac{m}{M}$RT,得到PM=$\frac{m}{V}$RT=ρRT,同温同压下,密度和气体摩尔质量呈正比,密度不相同,故B错误;
C.依据PV=$\frac{m}{M}$RT=nRT,体积相同时,温度压强不知,气体物质的量不一定相同,分子数不一定相同,故C错误;
D.质量相同,最简式均为CH2,则CH2的物质的量相同,原子的物质的量为CH2的物质的量的3倍,所以原子数目相同,故D正确;
故选D.
点评 本题考查阿伏伽德罗定律及推论,为高频考点,把握质量、物质的量、微粒数的关系为解答的关键,侧重分析能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子能够发生布朗运动而且能产生丁达尔现象 | |
| B. | 胶体粒子带电荷并且在一定条件下能稳定存在 | |
| C. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| D. | 胶体的分散质粒子直径在1nm~100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025mol | B. | 0.05mol | C. | 0.075mol | D. | 0.10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N | B. | O | C. | Na | D. | S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol铵根离子与[H3O]+构型相同 | |
| B. | 25℃时,pH=13的NaOH溶液中OH-的数目0.1NA | |
| C. | 常温常压下,92g NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 甲烷与Cl2光照下反应,主要生成2,4-二氯甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H2、HCN都是含有极性键的非极性分子 | |
| B. | CO2与SO2的空间构型相似,都是非极性分子 | |
| C. | HC≡C一CH(CH3)-CH=CH一CH3分子中含有1个手性碳原子 | |
| D. | 无机含氧酸分子中有几个氢原子,它就属于几元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
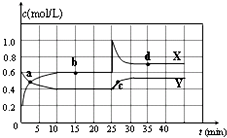 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入 一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入 一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )| A. | 图中的两条曲线,X是表示NO2浓度随时间的变化曲线 | |
| B. | 前10 min内用v(N2O4)表示的化学反应速率为0.2 mol/(L•min) | |
| C. | 25 min时,NO2转变为N2O4的反应速率增大,不可能是将密闭容器的体积缩小为1L引起的 | |
| D. | 前10 min内用v(NO2)表示的化学反应速率为0.04 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
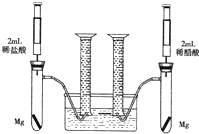 某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com