
【题目】在四个相同的容器中,在不同的温度下(其它条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是( )
A.v(NH3)=0.1 mol /(Lmin)B.v(H2)=0.6 mol /(Lmin)
C.v(N2)=0.005 mol /(Ls)D.v(H2)=0.3 mol /(Lmin)
【答案】C
【解析】
根据化学反应速率之比等化学计量数之比,换算为以同一个物质的化学反应速率进行比较;温度越高化学反应速率越快。
A.v(NH3)=0.1mol/(L![]() min);
min);
B.v(H2):v(NH3)=3:2,故v(NH3)=![]() v(H2)=
v(H2)=![]() ×0.6mol/(L
×0.6mol/(L![]() min)=0.4mol/(L
min)=0.4mol/(L![]() min);
min);
C.v(N2)=0.005 mol /(Ls)= 0.3 mol/(L![]() min),v(NH3):v(N2)=2:1,故v(NH3)=2v(N2)=2×0.3mol/(L
min),v(NH3):v(N2)=2:1,故v(NH3)=2v(N2)=2×0.3mol/(L![]() min)=0.6mol/(L
min)=0.6mol/(L![]() min);
min);
D.v(H2):v(NH3)=3:2,故v(NH3)=![]() v(H2)=
v(H2)=![]() ×0.3mol/(L
×0.3mol/(L![]() min)=0.2mol/(L
min)=0.2mol/(L![]() min),所以C的反应速率最快, C反应所处的温度最高,故选C。
min),所以C的反应速率最快, C反应所处的温度最高,故选C。


科目:高中化学 来源: 题型:
【题目】比较下列四组△H(所有的△H均小于0)的大小,其中△H2<△H1的是( )
A.4Al(s)+3O2(g)=2Al2O3(s) △H1 4Fe(s) +3O2(g)=2Fe2O3(s) △H2
B.C(s)+O2(g)=CO2(g) △H1 C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
C.S(g)+O2(g)=SO2(g) △H1 S(s)+O2(g)=SO2(g) △H2
D.A(g) +B(g)=C(g) △H1 A(g)+B(g)=C(l) △H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由碳、氢、氧3种元素组成的有机物A,相对分子质量为152,其分子中C、H原子个数比为1∶1,氧元素的质量分数为31.58%。A遇FeCl3溶液显紫色,A能与NaHCO3溶液反应,其苯环上的一氯取代物有两种,请回答下列问题:
(1)A的分子式是_______________________________。
(2)A的结构简式为________________________________________。
(3)A可以发生如图所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式________。

(4)甲、乙两装置均可用作实验室由C制取B的装置,乙图采用甘油浴加热(甘油沸点290 ℃,熔点18.17 ℃),当甘油温度达到反应温度时,将盛有C和浓硫酸混合液的烧瓶放入甘油中,很快达到反应温度。甲、乙两装置相比较,乙装置有哪些优点________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.室温下,向NH4HSO4溶液中加入NaOH溶液至中性,则c(![]() )>c(Na+)>c(
)>c(Na+)>c(![]() )
)
B.体积相等pH=12的氨水和NaOH溶液中和盐酸的能力相同
C.向10ml 0.01mol/L AgNO3溶液中依次滴入2~3滴0.01mol/L NaCl溶液、0.01mol/L NaI溶液,所得沉淀由白色变成黄色,则可推知Ksp(AgI)<Ksp(AgCl)
D.物质的量浓度之比为1:2的CH3COOH和CH3COONa的混合溶液中: 2[c(CH3COOH)+c(CH3COO-)]=3c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
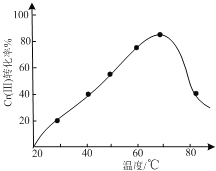
【题目】工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本。
(1)工业上处理100L Cr2O72-含量为108mgL-1的含铬废水,至少需要______L(标准状况) SO2。
(2)已知:Ksp[Cr(OH)3]=1×10-30,室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-6molL-1),需调节溶液pH______。
(3)三价铬Cr(III)与双氧水反应可用于合成铬黄(PbCrO4),控制其他条件不变,调节反应温度,考察反应温度对Cr(III)转化率的影响(如图所示),温度超过70℃时,Cr(III)转化率下降的原因是______。
(4)光照下,草酸(H2C2O4)也能将Cr2O72-转化为Cr3+,化学式为Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用,为确定一瓶久置发盐的化学成分,学习小组进行如下实验:
取一定质量的发盐样品溶于足量的稀硫酸中,将溶液分为两等份,其中一份与酸性KMnO4溶液充分反应(反应后MnO4-被还原成Mn2+),消耗浓度为0.4000molL-1的KMnO4溶液20.00mL;往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得9.100g干燥固体粉末。通过计算与合理猜想,推测该久置发盐的可能化学组成(请给出计算过程与推测理由)。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中可以说明2HI(g)![]() H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。( )
H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。( )
A. ②③⑤ B. ①④⑦ C. ②⑦⑨ D. ⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某溶液的离子组成,进行如下实验:①测定溶液的pH,溶液显强碱性。②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。③在上述②溶液中再滴加![]() 溶液,产生白色沉淀;④
溶液,产生白色沉淀;④![]() 取③中上层清液继续滴加
取③中上层清液继续滴加![]() 溶液至无沉淀时,再滴加
溶液至无沉淀时,再滴加![]() 溶液,产生白色沉淀。根据实验以下推测正确的是
溶液,产生白色沉淀。根据实验以下推测正确的是
A.一定有![]() 离子B.不一定有
离子B.不一定有![]() 离子
离子
C.不能确定![]() 离子是否存在D.不能确定
离子是否存在D.不能确定![]() 离子是否存在
离子是否存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)在2L的密闭容器中,充有2mol CO与4mol 水蒸气,在催化剂作用下进行如下化学反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
t(℃) | 750 | 850 | 1000 |
CO% | 0.7 | 2/3 | 0.5 |
1000℃时该反应的平衡常数为___________________。850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此时反应___________(填“向右进行”、“向左进行”或“处于平衡状态”)。
(2)已知:
C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
则CO和H2O生成CO2和H2的热化学方程式为_________________________。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
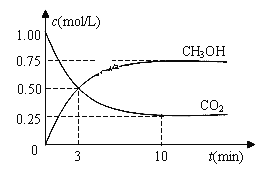
①从反应开始到平衡,氢气的平均反应速率v(H2)=_________
②若改变条件使平衡向正反应方向移动,则平衡常数_________
a.不变 b.减小 c.增大 d.不变或减小 e.不变或增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。试回答下列问题:
(1)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为______________。
(2)在25 ℃时,将a mol·L-1的KCN溶液与0.01 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a________0.01 mol·L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____________。
(3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为____________。上述转化的重要意义在于______________。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全________ (提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com