
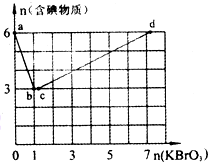
 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加人KBrO3的物质的量的关系如图所示.请回答下列问题:
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加人KBrO3的物质的量的关系如图所示.请回答下列问题:| 1 |
| 5 |
| 3 |
| 5 |
| 1 |
| 5 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 5 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、促进、促进、促进 |
| B、抑制、抑制、促进 |
| C、促进、抑制、抑制 |
| D、抑制、促进、抑制 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、在t1min时,3V正(B)=2V逆(C) |
| B、(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动 |
| C、T℃时,在相同容器中,若由0.3mol?L-1A、0.1 mol?L-1 B和0.4 mol?L-1 C反应,达到平衡后,C的浓度仍为0.4 mol?L-1 |
| D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大气中含有少量的有毒、有害的物质 |
| B、大气中有毒、有害的物质可以自净到正常值 |
| C、大气中某些有毒、有害物质的含量超过正常值或大气的自净能力 |
| D、空气中氮气的含量大于氧气的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Fe2+、NO3-、C1- |
| B、K+、HCO3-、SO42-、OH- |
| C、C1O-、C1-、Na+、H- |
| D、Ba2+、K+、SO42-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
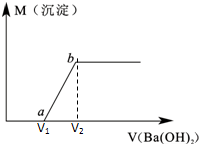 某溶液由盐酸、Na2CO3、H2SO4、CuCl2四种物质中的一种或几种混合形成,现向该混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示.
某溶液由盐酸、Na2CO3、H2SO4、CuCl2四种物质中的一种或几种混合形成,现向该混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com