
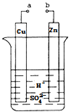
 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:分析 (1)该装置构成原电池,锌易失电子作负极、Cu作正极,负极电极反应为Zn-2e-=Zn2+、正极反应为2H++2e-=H2↑,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动;
(2)根据锌和转移电子之间的关系式计算.
解答 解:(1)该装置为原电池,锌易失电子作负极、Cu作正极,电解质溶液中氢离子向正极Cu极移动,正极上氢离子放电,电极反应为2H++2e-=H2↑,
故答案为:Cu;2H++2e-=H2↑;
(2)根据锌和转移电子之间的关系式得,消耗锌的质量=$\frac{0.2mol}{2}$=0.1mol,其质量为6.5g,
故答案为:6.5.
点评 本题考查了原电池原理,根据原电池反应特点、电极反应等知识点分析解答,铜锌原电池中电池反应式与锌发生化学腐蚀离子反应相同,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 提倡人们购物时减少使用塑料袋,是为了减少白色污染 | |
| B. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 硫氧化物和碳氧化物是形成酸雨的主要物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | Z元素氧化物对应水化物的酸性一定强于Y | |
| B. | X、Y、W中最简单氢化物稳定性最强的是X | |
| C. | 四种元素至少有一种为金属元素 | |
| D. | 最简单氢化物的沸点:X<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2与HCl加成 | |
| B. | CH3-CH2-CHOH-CH3消去反应 | |
| C. | C6H5-CH3在铁粉存在下与氯气反应 | |
| D. | CH3-CHOH-CH3在浓硫酸存在下,发生分子内脱水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 乙醇 | 天然气 | 浓硫酸 | 氢氧化钠 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的名称是3,4一二甲基辛烷
的名称是3,4一二甲基辛烷查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定前滴定管尖嘴有气泡,终点读数时无气泡,则测定结果偏大 | |
| B. | 滴定管用蒸馏水洗涤后,直接装入NaOH溶液进行滴定 | |
| C. | 用酚酞作指示剂,当锥形瓶中溶液由粉红色变无色时停止滴定 | |
| D. | 滴定时两眼应注视滴定管中液面的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl- | B. | Ag+ | C. | NO3- | D. | Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com