
【题目】亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂,某化学兴趣小组利用氮氧化物与过氧化钠反应制备亚硝酸钠并进行一系列实验探究。
查阅资料:
①SO2+Na2O2=Na2SO4,NO2和NO能与Na2O2发生类似反应。
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且有无色气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
I.制备亚硝酸钠

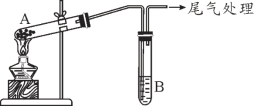
(1)装置A用恒压滴液漏斗,相比普通分液漏斗,显著的优点是______________________。
(2)上述装置按气流方向连接的顺序为:A→___________→___________→___________→C(填仪器编号,且都是左进右出)。
(3)如果没有B装置,D中发生反应的化学方程式为_________________________________。(有几个就写几个,填化学方程式)。
(4)C装置的作用是_________________________________(用离子方程式表示)。
Ⅱ.测定产品纯度,实验步骤:
①准确称量5.000g产品配成250mL溶液。
②从步骤①配制的溶液中移取25.00mL注入锥形瓶中。
③用0.1000mol/L酸性KMnO4溶液滴定至终点
④重复以上操作3次,消耗酸性KMnO4溶液的平均体积为20.00mL
(5)达到滴定终点的现象是____________________________________________。产品中NaNO2的纯度为___________%。
(6)设计实验证明HNO2的酸性比碳酸强_________________________________。
【答案】平衡烧瓶和漏斗内的压强,使漏斗内的液体顺利滴下 E B D 2NO![]() Na2O2 =2NaNO2,,2Na2O2
Na2O2 =2NaNO2,,2Na2O2![]() 2H2O=4NaOH
2H2O=4NaOH![]() O2↑,2NO
O2↑,2NO![]() O2=2NO2,2NO2
O2=2NO2,2NO2![]() Na2O2=2NaNO3 5NO
Na2O2=2NaNO3 5NO![]() 3MnO4-
3MnO4-![]() 4H+=3Mn2++5NO3-
4H+=3Mn2++5NO3-![]() 2H2O 滴入最后一滴高锰酸钾溶液,溶液由无色变成浅红色,且半分钟内不褪色, 69
2H2O 滴入最后一滴高锰酸钾溶液,溶液由无色变成浅红色,且半分钟内不褪色, 69![]() 。 可测量等浓度的HNO2和H2CO3的pH,HNO2的pH比H2CO3的pH小,pH越小酸性越强;或者测定等浓度的NaNO2和NaHCO3的pH,NaNO2 pH比NaHCO3的pH小,pH越小酸性越强
。 可测量等浓度的HNO2和H2CO3的pH,HNO2的pH比H2CO3的pH小,pH越小酸性越强;或者测定等浓度的NaNO2和NaHCO3的pH,NaNO2 pH比NaHCO3的pH小,pH越小酸性越强
【解析】
(1)A用恒压滴液漏斗,相比普通分液漏斗,具有能平衡烧瓶和漏斗内的压强,使漏斗内的液体顺利滴下的作用;
(2)浓硝酸和铜反应,生成二氧化氮,通入水中生成硝酸和一氧化氮,和过氧化钠反应前需要干燥一氧化氮,用高锰酸钾溶液吸收尾气;
(3)如果没有B装置,则NO中含有H2O,应还有H2O和Na2O2反应生成氧气,氧气和一氧化氮反应生成二氧化氮,二氧化氮和过氧化钠反应;
(4)C装置的作用是吸收NO;
(5)锥形瓶中发生的反应是:5NO2-![]() 2MnO4-
2MnO4-![]() 6H+=5NO3-
6H+=5NO3-![]() 2Mn2+
2Mn2+![]() 3H2O,所以当滴入最后一滴高锰酸钾溶液,溶液由无色变成浅红色,且半分钟内不褪色,即达到滴定终点,依据方程式计算纯度;
3H2O,所以当滴入最后一滴高锰酸钾溶液,溶液由无色变成浅红色,且半分钟内不褪色,即达到滴定终点,依据方程式计算纯度;
(6)利用酸性强弱的比较方法作答。
(1)A用恒压滴液漏斗,相比普通分液漏斗,具有能平衡烧瓶和漏斗内的压强,使漏斗内的液体顺利滴下的作用;
本题答案为:平衡烧瓶和漏斗内的压强,使漏斗内的液体顺利滴下。
(2)浓硝酸和铜反应,生成二氧化氮,通入水中生成硝酸和一氧化氮,和过氧化钠反应前需要干燥一氧化氮,用高锰酸钾溶液吸收尾气;所以连接顺序为:A→E→B→D→C;
本题答案为:E、B、D。
(3)有分析可知,如果没有B装置,D中发生反应的化学方程式为:2NO![]() Na2O2 =2NaNO2,,2Na2O2
Na2O2 =2NaNO2,,2Na2O2![]() 2H2O=4NaOH
2H2O=4NaOH![]() O2↑,2NO
O2↑,2NO![]() O2=2NO2,2NO2
O2=2NO2,2NO2![]() Na2O2=2NaNO3;
Na2O2=2NaNO3;
本题答案为:2NO![]() Na2O2 =2NaNO2,,2Na2O2
Na2O2 =2NaNO2,,2Na2O2![]() 2H2O=4NaOH
2H2O=4NaOH![]() O2,2NO
O2,2NO![]() O2=2NO2,2NO2
O2=2NO2,2NO2![]() Na2O2=2NaNO3;
Na2O2=2NaNO3;
(4)C装置的作用是吸收NO,在酸性条件下高锰酸钾溶液和一氧化氮反应的离子方程式为:5NO![]() 3MnO4-
3MnO4-![]() 4H+=3Mn2++5NO3-
4H+=3Mn2++5NO3-![]() 2H2O;
2H2O;
本题答案为:5NO![]() 3MnO4-
3MnO4-![]() 4H+=3Mn2++5NO3-
4H+=3Mn2++5NO3-![]() 2H2O。
2H2O。
(5)锥形瓶中发生的反应是:5NO2-![]() 2MnO4-
2MnO4-![]() 6H+=5NO3-
6H+=5NO3-![]() 2Mn2+
2Mn2+![]() 3H2O,所以当滴入最后一滴高锰酸钾溶液,溶液由无色变成浅红色,且半分钟内不褪色,即达到滴定终点,设250mlNaNO2的浓度为xmol/L,依据方程式可得:5:2=25x:(0.1
3H2O,所以当滴入最后一滴高锰酸钾溶液,溶液由无色变成浅红色,且半分钟内不褪色,即达到滴定终点,设250mlNaNO2的浓度为xmol/L,依据方程式可得:5:2=25x:(0.1![]() 20),x=0.2mol/L,所以n(NaNO2)=0.2mol/L
20),x=0.2mol/L,所以n(NaNO2)=0.2mol/L![]() 0.25L=0.05mol,故NaNO2的纯度为:
0.25L=0.05mol,故NaNO2的纯度为:![]() 100
100![]() =69
=69![]() ;
;
本题答案为:当滴入最后一滴高锰酸钾溶液,溶液由无色变成浅红色,且半分钟内不褪色,69![]() 。
。
(6)要证明HNO2的酸性比碳酸强,可测量等浓度的HNO2和H2CO3的pH,pH越小酸性越强,或者测定等浓度的NaNO2和NaHCO3的pH,pH越小酸性越强;
本题答案为:可测量等浓度的HNO2和H2CO3的pH,HNO2的pH比H2CO3的pH小,pH越小酸性越强;或者测定等浓度的NaNO2和NaHCO3的pH,NaNO2的pH比NaHCO3的pH小,pH越小酸性越强。


科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究 MnO2与FeCl3·6H2O反应产物。
(查阅资料)FeCl3是一种共价化合物,熔点306℃,沸点315℃。
实验编号 | 操作 | 现象 |
实验 1 | 按上图所示,加热A中MnO2与FeCl3·6H2O混合物 | ①试管A中固体部分变液态,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中KI-淀粉溶液变蓝 |
实验 2 | 把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热。 | A中固体部分变液态,产生白雾和黄色气体,B中KSCN溶液变红 |
(实验探究)实验操作和现象如下表:
(问题讨论)
(1)实验前首先要进行的操作是______________________________。
(2)实验1和实验2产生的白雾是_______(填化学式)溶解在水中形成的小液滴。
(3)请用离子方程式解释实验2中黄色气体使KI-淀粉溶液变蓝色的原因_____________。
(4)为确认黄色气体中含有Cl2,学习小组将实验1中试管B内KI-淀粉溶液替换为NaBr溶液,发现B中溶液呈橙色,经检验无Fe2+,说明黄色气体中含有Cl2。用铁氰化钾溶液检验Fe2+的离子方程式是_________________________________。选择NaBr溶液的原因是________________________________________________________________。
(实验结论)
(5)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为____________________________________________________。
(实验反思)
该学习小组认为实验1中溶液变蓝,也可能是酸性条件下,I-被空气氧化所致,可以先将装置中的空气排尽,以排除O2的干扰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多元素及它们的化合物在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。
(2)某同学画出基态碳原子的核外电子排布图:![]() ,该电子排布图违背了__;CH3+、—CH3、CH3—都是重要的有机反应中间体。CH3+、CH3—的空间构型分别为___、____。
,该电子排布图违背了__;CH3+、—CH3、CH3—都是重要的有机反应中间体。CH3+、CH3—的空间构型分别为___、____。
(3)基态溴原子的价层电子轨道排布图为_______,第四周期中,与溴原子未成对电子数相同的金属元素有_______种。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
① 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为_____,已知晶胞边长apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。

② 磷化硼晶胞沿着体对角线方向的投影(图乙中![]() 表示P原子的投影),用
表示P原子的投影),用![]() 画出B原子的投影位置_____。
画出B原子的投影位置_____。
(5)Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙(3、6、7、8、9、12号氧围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,晶体中正四面体空隙数与正八面休空隙数之比为__________,有__________%的正八面体空隙没有填充阳离子。

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图),己知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为_____g(用a、NA表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸乙酯具有抗炎作用且有治疗自身免疫性疾病的潜力,其合成路线及部分反应机理如图所示:

回答下列问题:
(1)B中官能团的名称是______________________。
(2)E→F反应类型为______________________。
(3)D分子中位于同一平面上的原子最多有___________个。
(4)F的结构简式为______________________。
(5)H→咖啡酸乙酯的化学方程式为____________________________________________。
(6)芳香族化合物M是H的同分异构体,1molM与足量碳酸氢钠溶液反应生成2molCO2,M的三取代基结构有___________种;M的两取代基同分异构体核磁共振氢谱为5组峰,峰面积比为1:2:2:2:1,其结构简式为______________________。
(7)设计以甲醛、C为原料合成C5H12O4( )的路线(无机试剂任选)。___________________________。
)的路线(无机试剂任选)。___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1。请回答下列问题:

(1)图中A、C分别表示________、_________,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是_________________________。
(2)图中△H=____________kJ·mol-1。
(3)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=_________υ(SO3)=___________。
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H(要求写出计算过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CaH2中Ca为+2 价,在该反应CaH2+2H2O=Ca(OH)2+2H2↑中,下列说法正确的是
A.CaH2是氧化剂B.H2都是氧化产物
C.CaH2中的氢元素既被氧化又被还原D.氧化产物与还原产物的质量比为1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com