
| A. | 配制一定物质的量浓度的溶液实验中,定容时,俯视观察刻度线,会引起配制溶液的浓度偏高 | |
| B. | 分液漏斗中上层和下层液体均可以从下口流出 | |
| C. | 冷凝管使用时冷水既可以从上口进也可以从下口进 | |
| D. | 不能用丁达尔效应鉴别Fe(OH)3胶体和CuSO4溶液 |
分析 A.配制一定物质的量浓度溶液时,定容时俯视刻度线导致配制溶液体积偏小;
B.分液时,上层液体从上口倒出,下层液体从下口倒出;
C.冷凝管中的水采用逆流方式;
D.胶体具有丁达尔效应,溶液没有丁达尔效应.
解答 解:A.配制一定物质的量浓度溶液时,定容时俯视刻度线导致配制溶液体积偏小,溶质的物质的量不变,导致配制溶液浓度偏高,故A正确;
B.分液时,上层液体从上口倒出,下层液体从下口倒出,否则引进杂质,故B错误;
C.冷凝管中的水采用逆流方式,所以冷凝管使用时冷水既从下口进也可以从上口进,否则馏分急剧冷却而炸裂冷凝管,故C错误;
D.胶体具有丁达尔效应,溶液没有丁达尔效应,所以可以用丁达尔效应鉴别Fe(OH)3胶体和CuSO4溶液,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及溶液配制、分液、馏分冷凝、物质鉴别等知识点,侧重考查实验操作、实验评价能力,明确实验原理及实验操作规范性是解本题关键,易错点是A中误差分析,题目难度不大.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
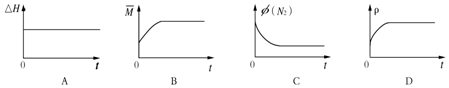
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能产生丁达尔效应 | |
| B. | 有相同的颜色 | |
| C. | 分散质颗粒直径都在1-100nm之间 | |
| D. | 加入浓氢氧化钠溶液都产生红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4 L CCl4、CO2含有的分子数为NA | |
| B. | 通常状况下,NA个CO2分子占有的体积约为22.4 L | |
| C. | 常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
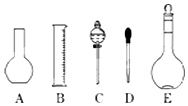 实验室需要0.1mol/L NaOH溶液500mL.根据这种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液500mL.根据这种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 增大N2浓度可以使H2转化率达到100% | |
| D. | 增大N2浓度可以减小反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com