
若两短周期中的元素原子,可以以共键结合化学式为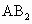 型分子,则A、B的原子序数①相差1,②相差2,③相差6,④相差8.其中可能的是
型分子,则A、B的原子序数①相差1,②相差2,③相差6,④相差8.其中可能的是
[ ]
|
A.只有① |
B.②④ |
|
C.②③④ |
D.①②③④ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| △ |
| △ |
| ||
| ||
| 高温 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | U | V | W | X | Y | Z | M |
| 原子半径/nm | 0.037 | 0.157 | 0.074 | 0.075 | 0.077 | 0.143 | 0.102 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | +3 | -2,+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
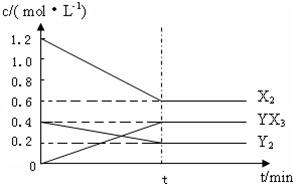
查看答案和解析>>
科目:高中化学 来源:四川省乐山市2009届高三上学期第一次模拟考试、理科综合能力测试化学试题 题型:022
下表是短周期中部分元素的原子半径及主要化合价.
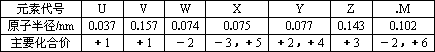
请回答:
(1)X在元素周期表中的位置是________;
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺是________(用元素符号表示);并用离子方程式表示出Z离子可作净水剂的原因________.
(3)M的单质能跟V的最高价氧化物水化物的热浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式________.
(4)W、X、Y分别与U均可形成10电子共价化合物,晶体类型均为________,其中,属于非极性分子的是(写化学式)________,若将其作为燃料,以熔融的K2CO3为电解质,空气作为氧化剂,并选择适当的隋性电极,组成原电池.写出该电池工作时的负极反应式________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)下表是短周期中部分元素的原子半径及主要化合价。
元素代号 | U | V | W | X | Y | Z | .M |
原子半径/nm | 0.037 | 0.157 | 0.074 | 0.075 | 0.077 | 0.143 | 0.102 |
主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | +3 | -2,+6 |
请回答:
(1)X在元素周期表中的位置是 ;
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺是
(用元素符号表示);并用离子方程式表示出Z离子可作净水剂的
原因 。
(3)M的单质能跟V的最高价氧化物水化物的热浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式____________ _____ _。
(4)W、X、Y分别与U均可形成10电子共价化合物,晶体类型均为 ,其中,属于非极性分子的是(写化学式)__ ,若将其作为燃料,以熔融的K2CO3为电解质,空气作为氧化剂,并选择适当的隋性电极,组成原电池。写出该电池工作时的负极反应式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com