
| A. | 将0.2 mol/L的一元酸HA溶液和0.1 mol/L的NaOH溶液混合,混合液中一定有:c(OH-)+c(A-)=c(H+)+c(Na+) | |
| B. | 某溶液中由水电离出的c(OH-)=1×10-9mol/L,则该溶液的pH一定为5 | |
| C. | 室温下,NaHSO3溶液的pH<7,则溶液中c(SO32-)<c(H2SO3) | |
| D. | Na2CO3溶液与NaHCO3溶液混合一定有2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] |
分析 A.溶液呈电中性,存在电荷守恒,结合含有的离子进行判断;
B.该溶液可能是酸的溶液,也可能是盐的溶液;
C.室温下,NaHSO3溶液的pH<7,说明HSO3-的电离程度大于其水解程度;
D.由物料守恒可知,等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合中存在2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)].
解答 解:A.溶液呈电中性,由电荷守恒可得:c(OH-)+c(A-)=c(H+)+c(Na+),故A正确;
B.溶液中水电离的离子与氢氧根离子浓度相等,该溶液若是酸的溶液,溶液的pH为5,若是盐的溶液,该溶液的pH可能为9,故B错误;
C.室温下,NaHSO3溶液的pH<7,说明HSO3-的电离程度大于其水解程度,则c(SO32-)>c(H2SO3),故C错误;
D.由物料守恒可知,等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合中存在2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],但二者物质的量浓度不一定相等,故D错误.
故选:A.
点评 本题考查离子浓度大小比较、溶液pH计算等,注意对电荷守恒与物料守恒的理解,在离子浓度等量关系中经常利用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | H2S的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-H+ | |
| B. | S2-的结构示意图: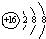 | |
| C. | Na2O2的电子式:Na+[$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$]2-Na+ | |
| D. | CCl4的电子式: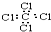 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )
用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )| A. | 选用酚酞作指示剂的滴定终点的判断:当浅红色变为无色且半分钟内仍为无色时即为滴定终点 | |
| B. | 滴定终点读数时,俯视滴定管的刻度(其他操作均正确),会造成测定结果偏低 | |
| C. | 甲滴定管中盛有H2SO4溶液,液面恰好在10.00mL刻度处,并把甲滴定管中的H2SO4溶液全部放入烧杯中,其体积为40.00mL | |
| D. | 量取15.00mLKMnO4溶液应选择乙滴定管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | H2SO3 | HSO3- | H2CO3 | HCO3- |
| PKa | 1.9 | 7.2 | 6.4 | 10.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | a | b | c | d |
| A | Pt | Pt | NaOH | NaOH |
| B | C | C | NaCl | NaOH |
| C | Cu | Cu | CuSO4 | Cu(OH)2 |
| D | Pt | Pt | H2SO4 | H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后盐水解使溶液呈碱性 | B. | 弱酸溶液和强碱溶液反应 | ||
| C. | 强酸溶液和弱碱溶液反应 | D. | 一元强酸溶液和一元强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、Cl-、NO3- | B. | Na+、Ca2+、SO32-、ClO- | ||
| C. | Al3+、K+、OH-、NO3- | D. | Na+、Ca2+、SiO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
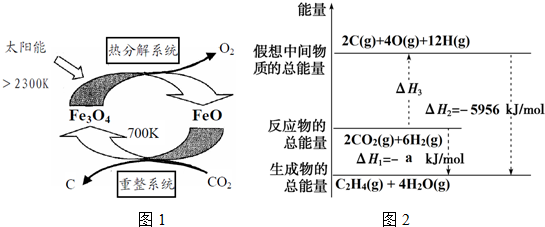
| 物质 | CO2(g) | C2H4(g) | H2O(g) |
| 能量/kJ•mol-1 | -394 | 52 | -242 |
| 化学键 | C=O | H-H | C=C | O-H |
| 键能/kJ•mol-1 | 803 | b | 615 | 463 |
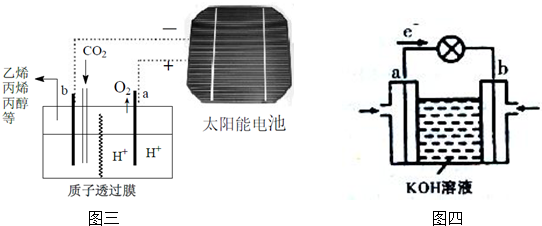
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com