
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如表所示,则下列判断正确的是( )
甲 | 乙 | |
丙 | 丁 | 戊 |
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法正确的是( )
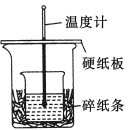
A.如图条件下实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填碎纸条的主要作用是固定小烧杯
D.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求放出热量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:
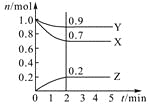
(1)该反应的化学方程式为 。
(2)反应开始至2 min,用Y表示的平均反应速率为 ,X的转化率为 。
(3)在一定温度下,下列情况可作为上述反应达到反应限度的标志的是 。
A.X、Y、Z的浓度相等 |
B.X、Y、Z的分子数比为3︰1︰2 |
C.Z的生成速率是Y的生成速率的二倍 |
D.单位时间内生成n mol Y,同时生成3n mol X |
(4)在密闭容器里,通入a mol A(g)和b mol B(g),
发生反应A(g)+ B(g)= 2C(g),当改变下列条件时,会加快反应速率的是 (填序号)。
①降低温度
②保持容器的体积不变,充入氦气
③加入催化剂
④保持容器的体积不变,增加A(g)的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较下列各组热化学方程式中ΔH的大小关系。
(1)S(s)+O2(g)===SO2(g) ΔH1
S(g)+O2(g)===SO2(g) ΔH2
ΔH1__________ΔH2
(2)CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
ΔH1__________ΔH2
(3)4Al(s)+3O2(g)===2Al2O3(s) ΔH1
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH2
ΔH1__________ΔH2
(4)煤作为燃料有2种途径:
途径1——直接燃烧:
C(s)+O2(g)===CO2(g) ΔH1<0
途径2——先制水煤气:
C(s)+H2O(g)===CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
2CO(g)+O2(g)===2CO2(g) ΔH3<0
2H2(g)+O2(g)===2H2O(g) ΔH4<0
ΔH1、ΔH2、ΔH3、ΔH4的关系式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3的制取方法及Na2CO3和NaHCO3综合实验探究
Ⅰ. (1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下:
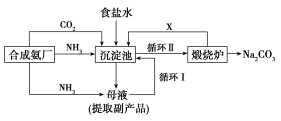
①往饱和食盐水中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是_______________________________________________。
②写出沉淀池中反应的化学方程式_______________________________________________。
Ⅱ.某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(2)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为_______________________________________________。
(3)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:_______________________。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是________(填字母序号)。
a.溶液温度下降
b.溶液温度升高
c.滴入酚酞后呈浅红色
d.滴入酚酞后呈红色
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO浓度较大,能与CaCl2发生反应:Ca2++CO===CaCO3↓ (离子方程式) |
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO浓度很小,不能与CaCl2反应 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是( )
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢.(C的相对原子质量为12,H的相对原子质量为1)
(1)A的结构简式为 ;
(2)A中的碳原子是否都处于同一平面? (填“是”或者“不是”);
(3)在图中,D1、D2互为同分异构体,E1、E2互为同分异构体.

反应②的化学方程式为
C的化学名称为
E2的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组的电极材料和电解液,不能组成原电池的是( )
A.铜片、石墨棒,稀硫酸
B.铜片、石墨棒,硝酸银溶液
C.锌片、铜片,稀盐酸
D.铜片、银片,FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1表示一些晶体中的某些结构,他们分别是氯化钠、氯化铯、干冰、金刚石、石墨结构中的某一种的某一部分(黑点可表示不同或相同的粒子).

(1)其中代表金刚石的是 (填编号字母,下同),金刚石中每个碳原子与 个碳原子最接近且距离相等.
(2)其中代表石墨的是 ,其中每个正六边形占有的碳原子数平均为 个;
(3)其中表示氯化钠的是 ,每个钠离子周围与它最接近且距离相等的钠离子有 个;
(4)代表氯化铯的是 ,每个铯离子与 个氯离子紧邻;
(5)代表干冰的是 ,每个二氧化碳分子与 个二氧化碳分子紧邻;
(6)由Mg、C、Ni三种元素形成的一种具有超导性的晶体,晶胞如图2所示.Mg位于C和Ni原子紧密堆积所形成的空隙当中.与一个Ni原子距离最近的Ni原子的数目为 ,该晶体的化学式为 .若该晶体的相对分子质量为M,阿伏加德罗常数为NA,Mg、C、Ni三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为 gcm﹣3.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com