
【题目】NA为阿伏加德罗常数的值,下列叙述正确的一组是( )
A.由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2 g H2,则电路通过电子0.4NA
B.18 g D2O中含有的质子数目为10NA
C.在标准状况下,22.4L正戊烷的所含的原子数为17NA
D.常温常压下,16 g O3所含的原子数为NA
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除![]() 外,含有
外,含有![]() 、
、![]() 、
、![]() 等)中回收碘,实验过程如下:
等)中回收碘,实验过程如下:

(1)向含碘废液中加入稍过量的![]() 溶液,将废液中的
溶液,将废液中的![]() 还原为
还原为![]() ,其离子方程式为__________;该操作将
,其离子方程式为__________;该操作将![]() 还原为
还原为![]() 的目的是___________________。
的目的是___________________。
(2)操作![]() 的名称为__________。
的名称为__________。
(3)氧化时,在三颈瓶中将含![]() 的水溶液用盐酸调至
的水溶液用盐酸调至![]() 约为2,缓慢通入
约为2,缓慢通入![]() ,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是__________________;仪器a、b的名称分别为:a__________、b__________;仪器b中盛放的溶液为__________。
,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是__________________;仪器a、b的名称分别为:a__________、b__________;仪器b中盛放的溶液为__________。

(4)已知:![]() ;某含碘废水(
;某含碘废水(![]() 约为8)中一定存在
约为8)中一定存在![]() ,可能存在
,可能存在![]() 、
、![]() 中的一种或两种。请补充完整检验含碘废水中是否含有
中的一种或两种。请补充完整检验含碘废水中是否含有![]() 、
、![]() 的实验方案(实验中可供选择的试剂:稀盐酸、淀粉溶液、
的实验方案(实验中可供选择的试剂:稀盐酸、淀粉溶液、![]() 溶液、
溶液、![]() 溶液)。
溶液)。
①取适量含碘废水用![]() 多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
②__________________;
③另从水层中取少量溶液,加入![]() 淀粉溶液,加盐酸酸化后,滴加
淀粉溶液,加盐酸酸化后,滴加![]() 溶液,若溶液变蓝说明废水中含有
溶液,若溶液变蓝说明废水中含有![]() ;否则说明废水中不含有
;否则说明废水中不含有![]() 。
。
(5)二氧化氯(![]() ,黄绿色易溶于水的气体)是高效、低毒的消毒剂和水处理剂。现用
,黄绿色易溶于水的气体)是高效、低毒的消毒剂和水处理剂。现用![]() 氧化酸性含
氧化酸性含![]() 废液回收碘。
废液回收碘。
①完成![]() 氧化
氧化![]() 的离子方程式:
的离子方程式:![]() ClO2+
ClO2+![]() I-1+
I-1+![]() __________=
__________=![]()
![]() +
+![]() Cl-1+
Cl-1+![]() ____________________________;
____________________________;
②若处理含![]() 相同量的废液回收碘,所需
相同量的废液回收碘,所需![]() 的物质的量是
的物质的量是![]() 的______倍。
的______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的NaSO4、KAl(SO4)2、Al2(SO4)3,三种溶液分别与等体积、等浓度的BaCl2溶液完全反应,则三溶液的物质的量浓度之比为
A.1:2:3
B.3:2:1
C.6:3:2
D.2:3:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016·新课标I]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]_______________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是______________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________,微粒之间存在的作用力是_______________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为_______________。
,0)。则D原子的坐标参数为_______________。
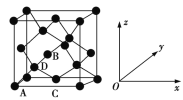
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为_____g·cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够说明反应 I2(g)+ H2![]() 2HI(g)已达平衡状态的是
2HI(g)已达平衡状态的是
A.一个H—H键断裂的同时有2个H-I键形成
B.v(H2)正=v(HI)逆时的状态
C.恒温恒容时,体系的颜色不再发生变化的状态
D.恒温恒容时,反应混合物总质量保持不变的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温、催化剂条件下,某反应达到平衡,平衡常数K=c(CO)c(H2O)/c(CO2)c(H2)。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A. 该反应为吸热反应 B. 恒温恒容下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小 D. 该反应的化学方程式为CO+H2O(g)![]() CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿扎西隆(azasetron)适用于治疗由服用药物引起的恶心、呕吐等消化道症状。它可由水杨酸甲酯(a)为原料合成,部分合成路线如下:
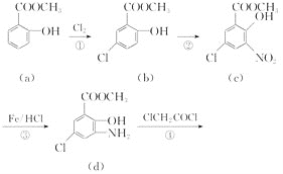

试回答下列问题:
(1)阿扎西隆的分子式为________;c物质中含氧官能团的名称是________。
(2)反应②所用试剂是________。
(3)1 mol b物质与足量NaOH溶液反应,最多消耗________mol NaOH。
(4)水杨酸甲酯(a)的同分异构体中,满足下列条件的共有________种。
A.与碳酸氢钠溶液反应放出二氧化碳
B.与氯化铁溶液反应显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是探究化学过程的重要途径,有关下列各实验装置图的叙述正确的是( )
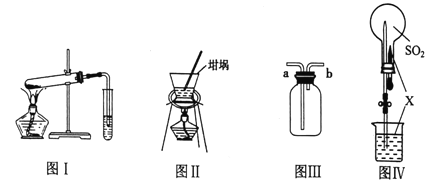
![]()
A. 图I可用于探究 NaHCO3固体的热稳定性
B. 图Ⅱ用于从氯化钠溶液中获得晶体
C. 图III中b口进气可收集Cl2、CO2等气体
D. 图Ⅳ中若X为NaOH溶液,则可完成SO2的喷泉实验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com