
【题目】针对下面10种元素,完成以下各小题。
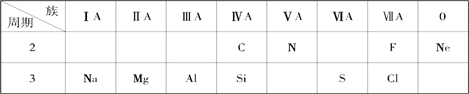
(1)金属性最强的元素是________(填名称);化学性质最不活泼的元素是________(填元素符号)。
(2)S 原子结构示意图为___________;
(3)除Ne以外的其余九种元素的原子中,原子半径最小的是___________(填元素符号);
(4)元素硅的氧化物常用于制造___________(填一种高性能的现代通讯材料的名称);
(5)氮元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型为_______________;氮元素的氢化物与氯元素的氢化物能生成盐W,W的电子式为____________________。
(6)元素最高价氧化物对应的水化物中,碱性最强的是_______(填化学式),呈两性的是_________(填化学式);两者反应的化学方程式__________________________。
【答案】 钠(或钠元素) Ne  F 光导纤维 离子键和共价键
F 光导纤维 离子键和共价键 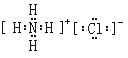 NaOH Al(OH) 3 NaOH + Al(OH) 3= NaAlO2 + 2H2O
NaOH Al(OH) 3 NaOH + Al(OH) 3= NaAlO2 + 2H2O
【解析】(1)根同周期自左而右金属性减弱,同主族自上而下金属性增强,金属性最强的元素处于周期表的左下角,Na元素的金属性最强金属性最强的元素是钠(或钠元素);Ne最外层达到稳定结构,化学性质最不活泼的元素是Ne(填元素符号)。
(2)S为16号元素,有三个电子层,S 原子结构示意图为 ;(3)同周期随原子序数的增大,核电荷数对核外电子引力增大,原子半径减小,同主族从下往上,原子半径减小,除Ne以外的其余九种元素的原子中,原子半径最小的是F(填元素符号);
;(3)同周期随原子序数的增大,核电荷数对核外电子引力增大,原子半径减小,同主族从下往上,原子半径减小,除Ne以外的其余九种元素的原子中,原子半径最小的是F(填元素符号);
(4)元素硅的氧化物SiO2常用于制造光导纤维(填一种高性能的现代通讯材料的名称);(5)氮元素的最高价氧化物对应水化物与其氢化物能生成盐M为NH4NO3,M中含有的化学键类型为离子键(NH4+ 和NO3―)和共价键(N―O和N―H键);氮元素的氢化物与氯元素的氢化物能生成盐W,W的电子式为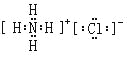 。
。
(6)根同周期自左而右金属性减弱,同主族自上而下金属性增强,金属性最强的元素处于周期表的左下角,Na元素的金属性最强金属性最强的元素是钠,元素最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式),呈两性的是Al(OH) 3(填化学式);两者反应的化学方程式NaOH + Al(OH) 3= NaAlO2 + 2H2O。


科目:高中化学 来源: 题型:
【题目】人体每天均需要从食物中获取各种营养物质。下列不属于人体能消化吸收的营养素是( )
A. 糖类、油脂 B. 蛋白质、维生素
C. 水、矿物质 D. 纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去)。已知A是由两种元素组成,其摩尔质量为32 g·mol-1,常用作火箭推进剂。B是一种红棕色气体,C是空气中含量最高的单质,D是最常见的液体,L为黄绿色气体,I是一种金属,K的焰色反应为黄色。

(1) J的化学式为______________。
(2) C的电子式为______________。
(3) 写出反应①的化学方程式:______________________________________________。
(4) 写出反应②的离子方程式:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种元素中,其单质氧化性最强的是( )。
A. 原子含有未成对电子最多的第2周期元素
B. 位于周期表第3周期ⅢA族的元素
C. 原子最外电子层排布式为2s22p6的元素
D. 原子最外电子层排布式为3s23p5的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的俗名与其化学式、用途都相符的是( )
A.烧碱、Na2CO3、制玻璃 B.小苏打、NaHCO3、治疗胃酸过多
C.苏打、NaOH、造纸 D.食盐、NaCl、化肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类组合全部正确的是( )
编组 | 强电解质 | 弱电解质 | 非电解质 |
A | NaCl | H2O | Cl2 |
B | H2SO4 | CaCO3 | CCl4 |
C | AgCl | HClO | Cu |
D | Ba(OH)2 | H2S | C2H5OH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如下反应的叙述正确的是
I :C(g)+H2O(g) ![]() CO(g)+H2(g) △H=+131.0kJ/mol
CO(g)+H2(g) △H=+131.0kJ/mol
II: CO(g) +H2O(g) ![]() CO2(g) + H2(g) △H=-43kJ/mol
CO2(g) + H2(g) △H=-43kJ/mol
III: CaO(s) + CO2(g)![]() CaCO3(s) △H =-178.3 kJ/mol
CaCO3(s) △H =-178.3 kJ/mol
IV: C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g) △H=akJ/mol
CaCO3(s)+2H2(g) △H=akJ/mol
A. a=+90.3
B. 恒温恒压下,在己达平衡的反应I体系中再充入少量He时平衡正向移动
C. 其他条件不变,加压对反应Ⅱ的反应速率无影响
D. 其他条件不变,升高温度可提高反应Ⅲ中CO2的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com