
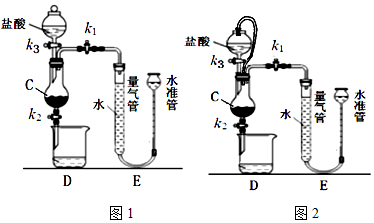
分析 铁屑用稀盐酸溶解得到氯化亚铁溶液,调节溶液pH并加热试剂X,将部分氧化为Fe2+氧化成Fe3+,可以是过氧化氢或氯水等,再加入NaOH溶液,加热得到纳米Fe3O4.
(1)铁过量会和铁离子发生氧化还原反应;
(2)①a.氢气不溶于水、四氯化碳,但CCl4易挥发;
b.量气管压与水准管液面等高,即可测定氢气体积;
c.读数是保证装置内压强与外界大气压相等,气体受热温度体积会增大,冷却后体积会减小;
②图2中分液漏斗连接橡胶管可以平衡压强使液体顺利流下;
(3)制备溶液A,试剂X是将部分氧化为Fe2+氧化成Fe3+,需要选择具有强氧化性的物质;
(4)Fe2+、Fe3+在碱性、加热条件下反应得到Fe3O4,还有水生成;制备中防止亚铁离子被氧气氧化;
(5)①铁离子将碘离子氧化为碘单质,加入淀粉溶液呈蓝色,滴定终点时蓝色褪去;
②根据关系式:Fe3O4~2Fe3+~I2~2S2O32-计算.
解答 解:铁屑用稀盐酸溶解得到氯化亚铁溶液,调节溶液pH并加热试剂X,将部分氧化为Fe2+氧化成Fe3+,可以是过氧化氢或氯水等,再加入NaOH溶液,加热得到纳米Fe3O4.
(1)铁过量会和铁离子发生氧化还原反应,反应的离子方程式为:Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
(2)①a.氢气不溶于水、四氯化碳,不影响沉淀氢气体积,且CCl4易挥发,污染空气,故a错误;
b.量气管压入水准管的水过多而溢出,但量气管压与水准管液面等高,即可测定氢气体积,不会导致实验失败,故b错误;
c.读数是保证装置内压强与外界大气压相等,气体受热温度体积会增大,冷却后体积会减小,应恢复室温,故c正确,
故答案为:ab;
②将装置D改为如图2装置,橡胶管的作用是:平衡气压使分液漏斗中的盐酸能顺利流下;且避免液体体积占位影响气体体积测定
故答案为:平衡气压使分液漏斗中的盐酸能顺利流下;且避免液体体积占位影响气体体积测定;
(3)制备溶液A,试剂X是将部分氧化为Fe2+氧化成Fe3+,需要选择具有强氧化性的物质,可以是氯气、过氧化氢,铁离子可以氧化二氧化硫,
故答案为:ac;
(4)Fe2+、Fe3+在碱性、加热条件下反应得到Fe3O4,还有水生成,反应离子方程式为:Fe2++2Fe3++8OH-$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2O,控制Fe2+、Fe3+、OH-的物质的量之比为:1:2:8,制备过程中须持续通入N2的原因是在 N2气流下,防止Fe2+被氧化,
故答案为:1:2:8;在 N2气流下,防止Fe2+被氧化;
(5)①铁离子将碘离子氧化为碘单质,加入淀粉溶液呈蓝色,用Na2S2O3溶液滴定滴定碘单质,滴定终点的现象是:溶液蓝色褪去,且半分钟不变色,
故答案为:溶液由蓝色变无色,且半分钟不变色;
②设样品中铁(Ⅲ)的物质的量为a,则:
Fe3O4~2Fe3+~I2~2S2O32-
2 2mol
a V×10-3L×cmol•L-1
a=cV×10-3mol,
样品中Fe(Ⅲ)的质量分数=$\frac{cV×1{0}^{-3}mol×\frac{100}{10}×56g/mol}{mg}$×100%=$\frac{56cV}{m}%$
故答案为:$\frac{56cV}{m}%$.
点评 本题考查物质制备实验与定量测定实验,关键是对原理的理解,掌握气体体积测量方法与滴定中关系式计算,熟练掌握元素化合物性质,题目培养了学生分析能力、知识迁移运用能力,题目难度中等.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
 如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置.
如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在使石蕊试液变红的溶液中:Na+、K+、Br-、SO42- | |
| B. | 氯化亚铁溶液中:K+、Al3+、SO42-、MnO4- | |
| C. | 硫酸铝溶液中:K+、AlO2-、Na+、Cl- | |
| D. | 与铝反应产生大量氢气的溶液:NH4+、Na+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 通入氯化氢气体 | ||
| C. | 加入适量的氢氧化钠溶液 | D. | 加入固体AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 8种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
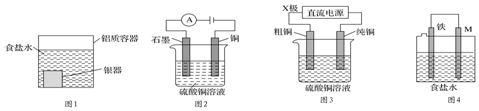
| A. | 用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-═2Ag+S2-,该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 | |
| B. | 用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变 | |
| C. | 图3装置中若直流电源的X极为正极,则该装置可实现粗铜的电解精炼 | |
| D. | 图4装置中若M是铜,则该装置能防止铁被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com