
【题目】下列有关晶体结构的叙述正确的是( )
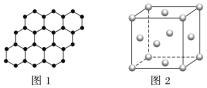
A.SiO2晶体中最小环上的原子个数为6
B.在晶体中只要有阳离子就一定有阴离子
C.12g石墨烯(如图1)中含有六元环的个数为0.5×6.02×1023
D.720gC60晶体中含有0.5×6.02×1023个晶胞(如图2每个小球代表一个C60)
【答案】C
【解析】
A.SiO2晶体结构中,每个硅原子结合4个氧原子,同时每个氧原子结合2个硅原子,SiO2最小环上有12个原子,即6个O,6个Si,A项错误;
B.晶体中只要有阳离子,不一定有阴离子,如金属晶体的组成微粒为金属阳离子和自由电子,B项错误;
C.12g石墨烯为1mol,石墨烯中平均每个六元环含有2个碳原子,则1mol石墨烯中含有六元环的个数为0.5×6.02×1023,C项正确;
D.C60为分子晶体,晶胞中含有C60的个数为![]() ,720gC60晶体中含有6.02×1023个C60,所以720 g C60晶体中含有0.25×6.02×1023个晶胞,D项错误;
,720gC60晶体中含有6.02×1023个C60,所以720 g C60晶体中含有0.25×6.02×1023个晶胞,D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】已知SO2通入BaCl2溶液无明显现象。某同学利用如图装置探究SO2与BaCl2溶液反应生成白色沉淀的条件。下列判断正确的是
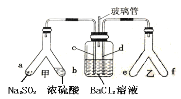
A.e、f两管中的试剂可以分别是浓氨水和NaOH固体
B.乙中产生的一定为氧化性气体,将BaSO3氧化为BaSO4沉淀
C.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
D.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是______(填序号)。
a.CH3CH3 b.CH3CHCl2 c.CH3CH2OH d.CH3CH2Br
(4)已知 2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
![]()
反应②的化学方程式为_________。 工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为_____________,反应类型是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置进行脱硫,将硫化氢气体转化成硫沉淀。已知甲、乙池中发生的反应为(右图):下列说法正确的是
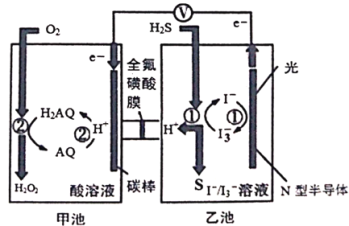
A. 甲池中得到H2O2的反应,H2O2既是氧化产物也是还原产物
B. 电路中每转移0.2mol电子,甲池溶液质量变化3.4g,乙池溶液质量保持不变
C. 光照时乙池电极上发生的反应为:H2S+I3-=3I-+S+2H+
D. 甲池中炭棒上发生的电极反应为:AQ+2H+-2e-=H2AQ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为: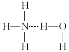
C. NCl3分子是非极性分子
D. NBr3比NCl3易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的衍生物A的化学式为C6H12O2,已知:

又知D不与Na2CO3反应,C和E均不能发生银镜反应,则A的结构可能有( )
A.2种B.3种C.4种D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结论与实验操作及现象不相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某酸雨样品中加入Ba(OH)2溶液,有白色沉淀生成 | 酸雨试样中一定含SO42- |
B | 向KI-淀粉溶液中滴入氯水,溶液变成蓝色 | I-的还原性强于Cl- |
C | 将Ba(OH)2·8H2O和NH4Cl晶体在小烧杯中混合搅拌,用手触摸烧杯外壁感觉变凉 | Ba(OH)2·8H2O与NH4Cl的反应是吸热反应 |
D | 向某盐溶液中加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口,试纸变蓝 | 该盐溶液中含有NH4+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁与稀硝酸的反应为:Mg+HNO3(稀)——Mg(NO3)2+NO↑+H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目_____________。
(2)该反应中,还原产物是_________,HNO3表现了___________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。还原剂与氧化剂的的物质的量之比为____________。
(3)若反应过程中转移的电子为0.6 mol,则被还原的硝酸物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
I.五种元素的原子电子层结构如下:A:1s22s22p63s23p63d54s2、B:1s22s22p63s2、C:1s22s22p6、D:1s22s22p63s23p2、E:[Ar]4s1。
请回答:(填元素符号)
(1)________元素是稀有气体。含未成对电子数最多的元素是________。
(2)A元素原子的核外电子共有________种运动状态,能量最高的能级是________(填能级符号)。
(3)D元素原子的价层电子排布图是________。
(4)________元素的电负性最大,________元素原子的第一电离能最大,________元素最可能生成具有催化性质的氧化物。
II.Q、R、X、Y、Z五种元素的原子序数依次递增,除Z以外,其余的均为短周期主族元素。已知:
①Q原子2p能级上有一个空轨道;
②R原子核外L层电子数为奇数;
③X原子2p轨道上只有一对自旋相反的电子;
④Y原子价电子(外围电子)排布msnmpn;
⑤Z原子M层所有轨道全部充满,N层无成对电子,只有1个未成对电子。请回答下列问题:
(5)Z2+的核外电子排布式是________,X元素基态原子的核外电子排布图是____________。
(6)Q与Y分别形成的最简单气态氢化物中,稳定性更强的是________(填化学式)。
(7)Q、R、X、Y三种元素的第一电离能数值由大到小的顺序为________(用元素符号作答)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com