
| 0.28mol |
| 0.4mol/L |


科目:高中化学 来源: 题型:
| A、K+、Na+、OH-、SO42- |
| B、Ba2+、Na+、HCO3-、Cl- |
| C、K+、Cu2+、Fe2+、NO3- |
| D、Mg2+、NH4+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
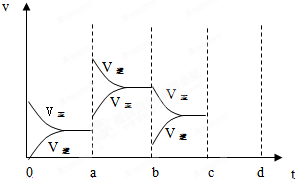
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 有关问题 |
| ①计算所需KCl的质量 | 需要称量KCl的质量为 |
| ②称量KCl固体 | 称量需要用到的主要仪器是: |
| ③将KCl加入100ml烧杯中,并加入适量水 | |
| ④将烧杯中溶液转移至500ml容量瓶中 | |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2cm处应如何操作: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用钠、镁分别与水反应,可证明钠、镁的金属性强弱 |
| B、用氯化镁、氯化铝分别与过量浓氨水反应,可证明镁、铝的金属性强弱 |
| C、用铁、石墨与硫酸铜溶液组成原电池,可证明铁、铜的金属性强弱 |
| D、把氯气通入到硫化钠的水溶液中,看到淡黄色沉淀,可证明氯气、硫的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
2- 4 |
| 实验序号 | 硫酸体积 | NaOH溶液体积 | NaOH溶液浓度 |
| ① | 5.00mL | 35.65mL | 5.00mol?L-1 |
| ② | 5.00mL | 39.65mL | 5.00mol?L-1 |
| ③ | 5.00mL | 35.55mL | 5.00mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

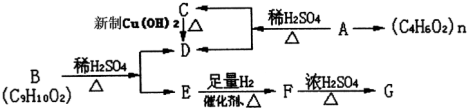
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内压强不随时间的变化而变化 |
| B、容器内A、B、C、D四者共存 |
| C、A、D的消耗速率相等 |
| D、C、D的生成速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
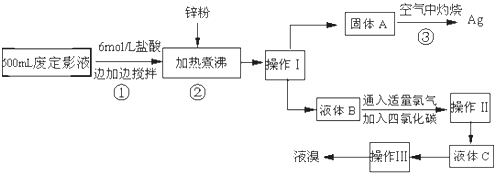
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com