
已知X、Y、Z、W、R五种元素,原子序数依次增大,且原子序数都小于20,X元素的原子是所有元素的原子中半径最小的,Y、W同主族,Z、W同周期,Y元素原子的最外层电子数是次外层的3倍,Z、R分别是同周期中金属性最强的元素。下列说法不正确的是( )
A.沸点:X2Y>X2W
B.由X、Y、Z、W四种元素组成的化合物既含有共价键又含离子键
C.原子半径:X<Y<Z<W<R
D.Y与W形成的化合物WY2是形成酸雨的主要物质之一
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学二轮专题突破 专题七化学反应与能量练习卷(解析版) 题型:选择题
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)  CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
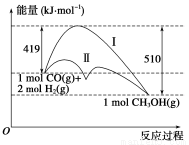
A.该反应的ΔH=+91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题8电化学原理练习卷(解析版) 题型:选择题
如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为:PbO2+Pb+4H++2S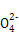 =2PbSO4+2H2O。下列有关说法正确的是( )
=2PbSO4+2H2O。下列有关说法正确的是( )
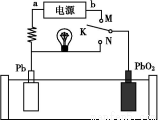
A.K与N相接时,能量由电能转化为化学能
B.K与N相接时,H+向负极区迁移
C.K与M相接时,阳极附近的pH逐渐增大
D.K与M连接时,所用电源的a极为负极
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
可逆反应3A(g) 3B+C ΔH>0,随着温度的升高,气体的平均相对分子质量有变小的趋势。下列关于B、C两种物质的聚集状态的判断不正确的是( )
3B+C ΔH>0,随着温度的升高,气体的平均相对分子质量有变小的趋势。下列关于B、C两种物质的聚集状态的判断不正确的是( )
A.B和C可能都是气体
B.B和C一定都是气体
C.若C为固体,则B一定是气体
D.有可能B为固体,C为气体
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题5物质结构 元素周期律练习卷(解析版) 题型:填空题
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:

(1)已知由①、③、④三种元素组成的某种常见化合物的水溶液呈酸性,则符合该条件的化合物的化学式可能为 (至少写两种)。
(2)由表中①、④两种元素按原子个数比为1∶1构成的化合物的稀溶液易被催化分解,通常使用的催化剂为 (填序号)。
a、MnO2 b、FeCl3 c、Na2SO3 d、KMnO4
(3)下图中A~F是由部分上表中元素组成的单质或化合物,其中A、B、C为单质,转化关系如下:

Ⅰ.若B为黄色固体,A为原子半径最小的原子组成的单质。
①F的电子式为 。
②实验测得起始参加反应的B和最后生成的B质量相等,则起始参加反应的A和C的物质的量之比是 。
Ⅱ.若D为淡黄色固体,焰色反应为黄色,组成C的元素的原子最外层电子数是内层电子数的2倍。
①下列关于D的说法正确的是 (填字母)。
a.能与水发生化合反应
b.既有氧化性,又有还原性
c.既含离子键,又含非极性共价键
d.是一种碱性氧化物
②用惰性电极将F的饱和溶液进行电解,则阳极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题5物质结构 元素周期律练习卷(解析版) 题型:选择题
2010年4月,科学家成功合成了一种拥有117个质子的新元素。科学家用 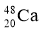 轰击
轰击 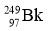 ,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,1个原子有177个中子。下列有关说法正确的是( )
,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,1个原子有177个中子。下列有关说法正确的是( )
A.第117号元素是副族元素
B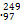 Bk的质量数为97
Bk的质量数为97
C.第117号元素是非金属元素
D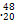 Ca2+的中子数比核外电子数多10
Ca2+的中子数比核外电子数多10
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题4化学反应中的能量变化练习卷(解析版) 题型:选择题
同温同压下,下列各组热化学方程式中,ΔH1<ΔH2的是( )
A.S(g)+O2(g)=SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2
B.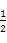 H2(g)+
H2(g)+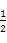 Cl2(g)=HCl(g) ΔH1H2(g)+Cl2(g)=2HCl(g) ΔH2
Cl2(g)=HCl(g) ΔH1H2(g)+Cl2(g)=2HCl(g) ΔH2
C.2H2(g)+O2(g)=2H2O(g) ΔH12H2(g)+O2(g)=2H2O(l) ΔH2
D.C(s)+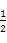 O2(g)=CO(g) ΔH1C(s)+O2(g)=CO2(g) ΔH2
O2(g)=CO(g) ΔH1C(s)+O2(g)=CO2(g) ΔH2
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题2化学常用计量 溶液练习卷(解析版) 题型:填空题
配制500 mL 0.5 mol/L的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为 。
(2)配制方法:设计五个操作步骤。
①向盛有NaOH固体的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm;
③将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④用少量的蒸馏水洗涤烧杯和玻璃棒2~3次,然后将洗涤液移入容量瓶;
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将操作步骤正确排序 。
(3)某学生实际配制NaOH溶液的浓度为0.48 mol/L,原因可能是 。
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存在少量蒸馏水
C.溶解后的烧杯未经多次洗涤
D.胶头滴管加水定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题12化学实验基本操作与方案设计练习卷(解析版) 题型:实验题
草酸亚铁(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水变浑浊,B中有黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1: ; 假设2:FeO; 假设3:FeO和Fe的混合物。
②设计实验方案证明假设3。
限选试剂:1.0 mol·L-1盐酸、3% H2O2溶液、0.1 mol·L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
实验步骤 | 现象与结论 |
步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡 | 若溶液颜色明显改变,且有 生成,则证明有铁单质存在 |
步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 |
|
步骤3:取步骤2得到的少量固体于试管中,滴加 |
|
Ⅱ:某草酸亚铁样品中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5Fe2+ +5C2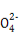 +3Mn
+3Mn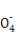 +24H+
+24H+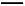 5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
①将准确称量的0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用浓度为0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8 min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2 mL。
③重复以上实验1~2次。
若某小组的一次测定数据记录如下:V1= 18.90 mL,V2=6.20 mL。根据数据计算0.20 g 样品中:n(Fe2+)= ; n(C2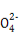 )= ;FeC2O4 的质量分数为 (精确到0.01%)。
)= ;FeC2O4 的质量分数为 (精确到0.01%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com