
 C(s)、CO(g)、H2(g)的燃烧烧(单位:kJ?mol-1)分别是-393.5、-283.0、-285.8.
C(s)、CO(g)、H2(g)的燃烧烧(单位:kJ?mol-1)分别是-393.5、-283.0、-285.8.| 1 |
| 2 |
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、麦芽糖及其水解产物均能发生银镜反应 |
| B、氨基酸和蛋白质遇双缩脲试剂时都会呈现紫玫瑰色 |
| C、当溶液中的氨基酸主要以两性离子的形态存在时,它在水中的溶解度最小,可以形成晶体析出 |
| D、天然植物油常温下一般呈液态,难溶于水,没有恒定的熔点,沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
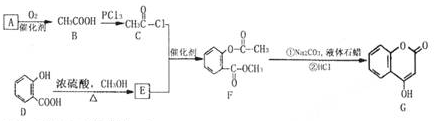
查看答案和解析>>
科目:高中化学 来源: 题型:
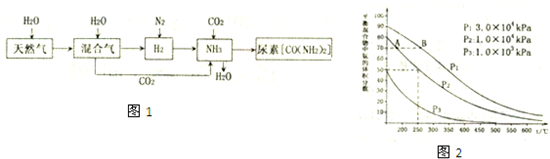
查看答案和解析>>
科目:高中化学 来源: 题型:
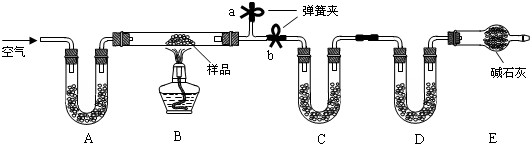
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 木质素是制浆造纸工业的副产物,具有优良的物理化学特点,若得不到充分利用,变成了制浆造纸工业中的主要污染源之一,不仅造成严重的环境污染,而且也造成资源的重大浪费.木质素的一种单体结构简式如图所示.下列说法正确的是
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,若得不到充分利用,变成了制浆造纸工业中的主要污染源之一,不仅造成严重的环境污染,而且也造成资源的重大浪费.木质素的一种单体结构简式如图所示.下列说法正确的是| A、遇FeCl3溶液呈血红色 |
| B、1mol该物质最多能消耗4mol H2 |
| C、1mol该物质最多能消耗4mol Br2 |
| D、该物质的分子式是C10H12O3,属于芳香烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com