
下列图示与对应的叙述不相符合的是

A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
科目:高中化学 来源:2016-2017学年江西省高一上月考二化学卷(解析版) 题型:填空题
在下列反应中:
A.
B.
C.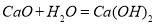
D.
(1)水只作氧化剂的是 (填序号,下同),水只作还原剂的是 ,水既作氧化剂又作还原剂的是 。
(2)用双线桥表示D反应中电 子转移情况。
子转移情况。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上月考三化学试卷(解析版) 题型:填空题
氧化锌吸收法常用作脱去冶金工业排放烟气中的SO2,其主要步骤如下:配制ZnO悬浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO(s)+SO2(g)=ZnSO3(s),
试回答下列问题:
(1)生成的ZnSO3可热分解处理,其目的是:①生成的高浓度SO2可以用来制备硫酸;②___________;
(2)已知:纯ZnO的悬浮液pH约为6.8.用氧化锌吸收法脱去烟气中SO2的过程中,测得pH随时间t的变化如图1所示。已知被吸收的SO2为c(SO2)吸,溶液中SO32-、HSO3-、H2SO3所占物质的量之比与pH的关系如图2所示。

①充分吸收烟气后的混合体系硫元素的主要存在形式是__________________;
②结合图1与图2分析,cd段发生的主要反应是__________________
③为提高SO2的吸收速率η,可采取的措施为 (填字母)。
A.调节悬浊液中ZnO的量
B.适当提高单位时间内烟气的循环次数
C.调节溶液的pH至6.0以下
(4)如用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)

b极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上月考三化学试卷(解析版) 题型:选择题
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(s)和q (s)反应生成NO(g)过程中的能量变化,下列说法中正确的是
A.1mol N2(g)和1mol O2(g)反应放出的能量为180kJ
B.1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
C.在1L的容器中发生反应,10min内N2减少了1mol,因此10min内的平均反应速率v(NO)=0.1mol/(L·min)
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:填空题
在下图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有KMnO4液滴;电源有a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如图所示。

则:①标出电源的正、负极:a为________极,b为______极。
②在湿的Na2SO4滤纸条中部的KMnO4液滴处有什么现象发生?__________________
③写出电极反应式:C中______________,D中______________。
④若电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,则检流计的指针是否移动?___________(填“是”或“否”),其理由________________。写出电极反应式:A中 ,B中__ _。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
已知:4NH3(g)+5O2(g)  4NO(g)+6H2O(g) △H=-1 025kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g) △H=-1 025kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )

查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
等物质的量浓度的下列五种溶液:①CH3COOH ②(NH4)2CO3 ③NaHSO4 ④Ba(OH)2 ⑤NH4Cl溶液中水的电离程度由大到小排列正确的是
A.④⑤③①② B.②⑤①④③ C.②⑤③①④ D.②⑤①③④
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上期中化学试卷(解析版) 题型:选择题
某溶液中含有如下离子组中的若干种:K+、Mg2+、Fe3+、Fe2+、CO32-、NO3-、SO42-、I-、SiO32-、Cl-,且物质的量浓度相同。某同学欲探究该溶液的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到浅紫色火焰;
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成;
Ⅲ.取Ⅱ反应后的溶液分置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层出现紫红色。下列说法正确的是( )
A.原溶液中肯定不含Mg2+、SiO32-
B.步骤Ⅱ中无色气体可能含有CO2,原溶液中可能含有CO32-
C.原溶液由K+、Fe2+、NO3-、I-、SO42-五种离子组成
D.原溶液中一定含有Mg2+、Cl-
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江牡丹江高级中学高三上期中化学卷(解析版) 题型:选择题
反应:MgSO4(s) + CO(g) MgO(s)+CO2(g)+SO2(g) ΔH>0。在恒
MgO(s)+CO2(g)+SO2(g) ΔH>0。在恒 容密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,y随x变化趋势合理的是
容密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,y随x变化趋势合理的是
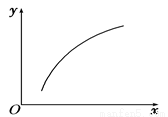
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com