
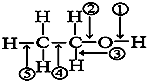
| A、和金属钠作用时,键①断裂 |
| B、和浓硫酸共热至170℃时,键②和⑤断裂 |
| C、和乙酸、浓硫酸共热时,键②断裂 |
| D、在银催化下和氧气反应时,键①和③断裂 |


科目:高中化学 来源: 题型:

| 过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中 含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO |
| 乙 | 既有Fe3+又有Fe2+ | 有SO |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
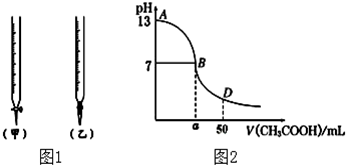
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
| 待测氢氧化钠 | 0.100mol/L醋酸的体积 | ||
| 滴定次数 | 溶液的体积(mL) | 滴定前的刻度(mL) | 滴定后的刻度(mL) |
| 第一次 | 25.00 | 0.00 | 24.98 |
| 第二次 | 25.00 | 1.56 | 27.86 |
| 第三次 | 25.00 | 0.22 | 25.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、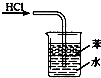 用于吸收HCl气体 |
B、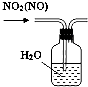 用于除去NO2中的NO |
C、 配制1mol/L NaCl溶液定容操作 |
D、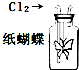 滴有淀粉碘化钾溶液的纸蝴蝶变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
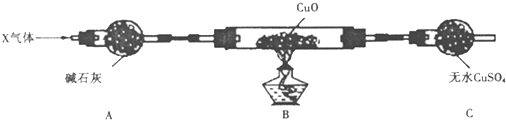
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解粗盐时,应尽量使溶液稀些,以保证食盐完全溶解 |
| B、滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩 |
| C、当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
| D、将制得的晶体转移到新制过滤器中用大量蒸馏水进行洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光导纤维、玻璃纤维、硝化纤维都是高分子化合物 |
| B、铜矿石在细菌作用下可直接转化为单质铜,这个过程叫生物炼铜 |
| C、凯库勒的“基团理论”尽管存在缺陷,但仍对有机化学的发展起到了巨大的推动作用 |
| D、“地沟油”危害健康,不仅是因为人体所必需的维生素E、脂肪酸油脂已经被破坏,营养低,而且含有黄曲霉素、苯并芘,这两种毒素都是致癌物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com