
(1)____HCl(浓)+____MnO2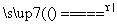 ____Cl2↑+____MnCl2+____H2O
____Cl2↑+____MnCl2+____H2O
(2)____Cu+____HNO3(稀)===____Cu(NO3)2+____NO↑+____H2O
(3)____KI+____KIO3+____H2SO4===____I2+____K2SO4+____H2O
(4)____MnO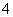 +____H++____Cl-===____Mn2++____Cl2↑+____H2O
+____H++____Cl-===____Mn2++____Cl2↑+____H2O
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
下列各反应中,生成物不随反应条件或反应物的用量变化而变化的是 ( )
A.Na和O2 B.NaOH和CO2
C.NaHCO3和NaOH D.Na2CO3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
| A | B | C | D | |
| 实验 | 用CCl4提取 溴水中的Br2 | 除去乙醇中的苯酚 | 从KI和I2的固体 混合物中回收I2 | 配制100 mL 0.1000 mol·L-1 K2Cr2O7溶液 |
| 装置或仪器 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂。
(1)高铁酸钾具有强氧化性的原因是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ,___ _____。
(3)制备K2FeO4可以采用干式氧化法或湿式氧化法。
① 干式氧化的初始反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2 mol Na2FeO4时转移电子 mol。
② 湿式氧化法的流程如下图:
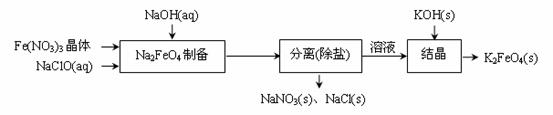
上述流程中制备Na2FeO4的化学方程式是 。
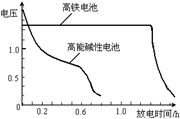
(4)高铁电池是正在研制中的可充电电池,右图为该电池和常用的高能
碱性电池的放电曲线,由此可得出的高铁电池的优点有 、
。
(5)探究高铁酸钾的某种性质。
【实验1】将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
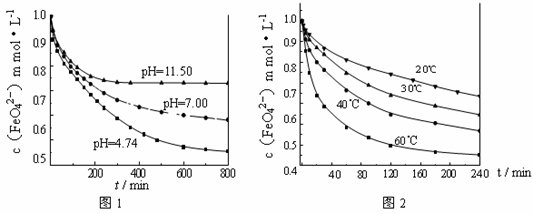
【实验2】将适量 K2FeO4 溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为
1.0 mmol·L-1 的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是 ;
②实验2可得出的结论是 ;
③高铁酸钾在水中的反应为4 FeO42—+10 H2O 4 Fe(OH)3 +8OH—+3 O2↑。 由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
4 Fe(OH)3 +8OH—+3 O2↑。 由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为 ( )
A.+2 B.+3 C.+4 D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
目前,新能源不断被应用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是________。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定。反应原理为
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO+2Fe(NO3)3+10NaOH===2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4
Na2FeO4+2KOH===K2FeO4↓+2NaOH
主要的生产流程如下:

①写出反应①的离子方程式________________________________________________。
②流程图中“转化”(反应③)是在某低温下进行的,且此温度无NaOH析出,说明此温度下Ksp(K2FeO4)____Ksp(Na2FeO4)(填“>”、“<”或“=”)。
(3)已知K2FeO4在水溶液中可以发生:__FeO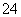 +__H2O__Fe(OH)3↓+__OH-+__O2↑,配平上述方程式K2FeO4在水处理中的作用是__________________。
+__H2O__Fe(OH)3↓+__OH-+__O2↑,配平上述方程式K2FeO4在水处理中的作用是__________________。
(4)FeO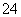 在水溶液中的存在形态如图所示:
在水溶液中的存在形态如图所示:
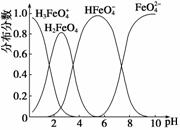
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO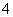 的分布分数的变化情况是________。
的分布分数的变化情况是________。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,________转化为____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
小明为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO2和NO,并验证其性质,装置图如下:
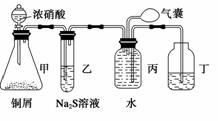
(1)写出甲中反应的离子方程式:______________________________________________
________________,乙中的现象是__________________________________________,
可证明NO2的氧化性;在丙中鼓入空气后现象是_______________________________
________________________________________________________________________,可证明NO的还原性。
(2)实验前丙中充满水的作用是_______________________________________________
________________________________________________________________________
(用反应方程式和简要文字回答)。
(3)小华对小明的实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是_________________________________________________________________
________________________________________________________________________。
你认为怎样才能准确证明NO2的氧化性?(简要回答出原理和现象即可)____________
____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
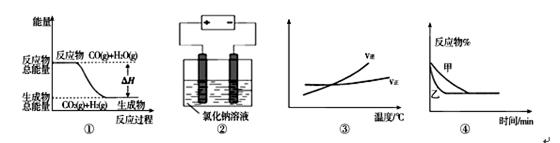
关于下列四个图象的说法中正确的是 ( )
A.图①表示可逆反应“CO(g)+H2O(g) CO2(g)+H2(g)”中的△H大于0
CO2(g)+H2(g)”中的△H大于0
B.图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1
C.图③表示可逆反应“A2(g)+3B2(g) 2AB3(g)”的△H小于0
2AB3(g)”的△H小于0
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com