
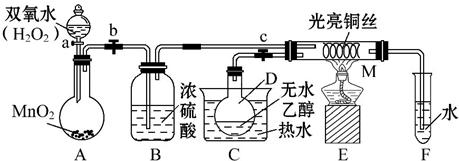
分析 (1)A中是过氧化氢在二氧化锰催化作用下生成水和氧气;B是吸收氧气中的水蒸气;C是加热乙醇得到乙醇蒸气进入M;
(2)在铜作催化剂、加热条件下,乙醇能被氧气氧化生成乙醛和水;
(3)铜丝做催化剂,和氧气反应生成氧化铜,和乙醇反应又生成铜,M管中铜网黑、红交替出现;催化剂参加反应过程,催化作用需要一定的温度;
(4)实验进行一段时间后,如果撤掉酒精灯,反应能继续进行,说明反应是放热反应;
(5)乙醇被氧化为乙醛,依据醛基检验方法进行设计实验,可以利用银氨溶液或新制的氢氧化铜检验.
解答 解:(1)A中是过氧化氢在二氧化锰催化作用下生成水和氧气,反应的化学方程式为2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;B是吸收氧气中的水蒸气;C是加热乙醇得到乙醇蒸气进入M,
故答案为:2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;干燥氧气(或吸收氧气中的水); C中热水使D中乙醇变为蒸气进入M中参加反应;
(2)在铜作催化剂、加热条件下,乙醇能被氧气氧化生成乙醛和水,所以M处发生反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(3)乙醇的催化氧化反应中,金属铜作催化剂,真正和乙醇反应起到氧化作用的是氧化铜,实验过程中铜网出现黑色,是由于铜和氧气反应生成氧化铜,反应的方程式为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,铜网由黑色变成红色是由于乙醇和氧化铜反应生成铜,反应的方程式为CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O,在反应前后,实际上铜参加反应,只是在初始反应中作反应物,在最终反应中作生成物,从表面上看没有参加反应,加热说明催化作用需要一定的温度,
故答案为:受热部分的铜丝交替出现变黑、变红的现象;参加;温度;
(4)撤掉酒精灯,反应仍进行,是因醇的催化氧化反应是放热反应,放出的热量满足反应所需温度,
故答案为:能;乙醇的催化氧化反应是放热反应,反应放出的热量能维持反应继续进行;
(5)乙醇被氧化为乙醛,乙醛含有醛基,具有还原性,能被银氨溶液或新制氢氧化铜悬浊液氧化,因此验证乙醇氧化产物的化学方法是:实验结束后,卸下装置F中盛有少量蒸馏水的试管中,加入新制的银氨溶液水浴加热,观察试管壁上有光亮的银镜生成,或取少量的氧化产物于试管中,加入新制的氢氧化铜悬浊液加热,观察有红色的沉淀生成,
故答案为:实验结束后,卸下装置F中盛有少量蒸馏水的试管,从中取出少许溶液做银镜反应实验[也可使之与新制Cu(OH)2悬浊液反应],来证明乙醛的生成.
点评 本题考查了物质性质的实验验证方法和实验设计,主要是过氧化氢的分解反应,乙醇的催化氧化产物判断和检验,注意:催化剂实际上在反应中参加反应,只是在初始反应中作反应物,在最终反应中作生成物,从表面上看没有参加反应,题目难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池 | |
| B. | 燃料电池是一种高效、对环境污染小的新型电池 | |
| C. | 化学电池的反应基础是氧化还原反应 | |
| D. | 铅蓄电池放电的时候负极是Pb正极是PbO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1NaCl溶液中含有0.1nA个Na+ | |
| B. | 标准状况下,22.4 L 苯含有nA个苯分子 | |
| C. | 7.8 g Na2O2与足量水反应转移0.2nA个电子 | |
| D. | 标准状况下,2.24 LCH4和C2H4混合气体中含有的H原子数为0.4nA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;Na+H2O═NaOH+H2↑ | |
| B. | 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2═2HCl | |
| C. | FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色; 2Fe(OH)2+O2+H2O═2 Fe(OH)3 | |
| D. | 向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有透明的硅酸凝胶产生;Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 溶液与胶体:本质区别是能否发生丁达尔效应 | |
| C. | 常温下可以用铝或铁制容器贮存浓硝酸和浓硫酸 | |
| D. | 用焰色反应鉴别NaCl溶液和Na2SO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com