
| A、XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY |
| B、XYZ3是一种微溶于水的盐,且Y与Z可形成共价化合物化合物YZ或YZ2 |
| C、XYZ3是一种易溶于水的盐,且X与Z可形成离子化合物XZ |
| D、XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3 |


科目:高中化学 来源: 题型:
A、苯的凯库勒式为 说明苯环中含有三个碳碳双键 说明苯环中含有三个碳碳双键 |
| B、苯不能与溴水发生取代反应 |
| C、邻二甲苯无同分异构体,说明苯分子结构中不是单双建交替的 |
| D、苯不能使酸性高锰酸钾褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
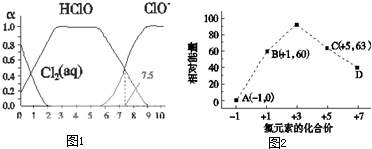
- x |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、每生成1 mol N2转移的电子的物质的量为6 mol |
| B、N2既是氧化剂,又是还原剂 |
| C、NH4Cl中的氮元素被还原 |
| D、NaNO2是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,18克H2O所含中子数为10 NA |
| B、标况下,2.24LBr2中含有的分子数目为0.1NA |
| C、7.8gNa2O2与足量的CO2反应转移的电子数为0.1NA |
| D、2.4 g金属镁变为镁离子时失去的电子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液操作时,分液漏斗中下层液体从下端放出,上层液体从上口倒出 |
| B、某固体中加入稀盐酸,产生无色无味且能使澄清石灰水变浑浊的气体,证明该固体中一定含有CO32- |
| C、向待测溶液中先加入BaCl2溶液,产生白色沉淀,再加入足量盐酸,沉淀不溶解,证明溶液中一定含有SO42- |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,将浓硫酸稀释后,应冷却至室温后再转移到容量瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com