
分析 已知 HX、HY、H2Z 三种酸的电离方程式为:
①HX?H++X-
②HY=H++Y-
③H2Z=2H++Z2+.
分析电离方程式可知,HX为弱酸、HY为强酸、H2Z为强酸,
(1)若 HX、HY、H2Z 三种酸的物质的量浓度相同时,HX存在电离平衡,H2Z为二元酸,溶液中氢离子浓度越大,溶液PH越小;
(2)若 HX、HY、H2Z 三种酸的物质的量浓度相同体积相同时,二元酸溶液中氢离子浓度大,HX弱酸溶液中氢离子浓度小,一元酸和氢氧化钠1:1反应,二元酸和氢氧化钠1:2反应,据此分析消耗物质的量浓度相同的 NaOH 的体积;
(3)若 HX、HY、H2Z 三种酸的氢离子的物质的量的浓度相同体积相同时,弱酸溶质浓度大,一元强酸和二元强酸中二元酸溶质浓度小,弱酸消耗氢氧化钠多,强酸溶液中氢离子浓度相同,消耗氢氧化钠相同,据此分析消耗物质的量浓度相同的 NaOH 的体积.
解答 解:已知 HX、HY、H2Z 三种酸的电离方程式为:
①HX?H++X-
②HY=H++Y-
③H2Z=2H++Z2+.
分析电离方程式可知,HX部分电离为弱酸、HY全部电离为强酸、H2Z全部电离为强酸,
(1)HX部分电离为弱酸、HY全部电离为强酸、H2Z全部电离为强酸,若 HX、HY、H2Z 三种酸的物质的量浓度相同时,HX存在电离平衡,H2Z为二元酸,溶液中氢离子浓度越大,溶液PH越小,设浓度都为1mol/L,则HX溶液中氢离子浓度小于1mol/L、HY溶液中氢离子浓度为1mol/L、H2Z 溶液中氢离子浓度为2mol/L,若三种酸的 PH 值分别是 a、b、c,则a、b、c 的关系是为a>b>c,
故答案为:弱酸、强酸、强酸;a>b>c;
(2)若 HX、HY、H2Z 三种酸的物质的量浓度相同体积相同时,二元酸溶液中氢离子浓度大,HX弱酸溶液中氢离子浓度小,氢离子的物质的量a、b、c大小关系为:c>b>a,一元酸和氢氧化钠1:1反应,二元酸和氢氧化钠1:2反应,消耗物质的量浓度相同的 NaOH 的体积 a、b、c 的关 系a=b=$\frac{1}{2}$c,
故答案为:c>b>a;a=b=$\frac{1}{2}$c;
(3)若 HX、HY、H2Z 三种酸的氢离子的物质的量的浓度相同体积相同时,弱酸溶质浓度大,一元强酸和二元强酸中二元酸溶质浓度小,HX、HY、H2Z 三种酸的物质的量浓度 a、b、c 的大小关系为:a>b>c,弱酸消耗氢氧化钠多,强酸溶液中氢离子浓度相同,消耗氢氧化钠相同,据此分析消耗物质的量浓度相同的 NaOH 的体积为:.a>b=c,
故答案为:a>b>c;a>b=c;
点评 本题考查了弱电解质电离平衡、酸碱反应定量关系、溶液PH大小比较、溶液浓度大小判断等知识点,主要是弱电解质电离平衡的理解应用,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(Z)>r(W)>r(X)>r(Y) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应水化物的酸性比W的强 | |
| D. | Y的气态简单氢化物的热稳定性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 mol/L | B. | 0.6 mol/L | C. | 1.7 mol/L | D. | 1.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
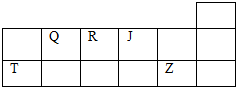
| A. | 元素第一电离能大小:J>R>Q | |
| B. | 含T元素的两种盐的溶液,一定不能相互反应 | |
| C. | Z的含氧酸一定为强酸 | |
| D. | Q、R、J三元素中J的电负性最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度 | 283K | 293K | 303K |
| 溶解度(g/100g H2O) | 2.5 | 3.9 | 5.6 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | 出现白色沉淀,说明该试剂中有Ba2+存在 |
| 步骤3:取适量步骤1中的沉淀于试管中,滴加稀盐酸连接带塞导气管将产生的气体导入澄清石灰水中. | 澄清石灰水变混浊.说明该试剂中含有BaCO3 |
| 步骤4:取步骤1中的滤液于烧杯中,用pH计测其pH值 | pH值明显大于9.6,说明该试剂中含有Ba(OH)2. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中二氧化碳的体积分数不变 | |
| B. | 密闭容器中气体的总物质的量改变 | |
| C. | 密闭容器中混合气体的密度不变 | |
| D. | 2v(NH3)正=v(CO2)逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②⑤⑥ | C. | ①②③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 g 氦气所含有的原子数目是0.25 NA | |
| B. | 常温常压下,0.5 mol Cl2所占有的体积约为11.2 L | |
| C. | 标准状况下,0.9 mL水的质量约为0.9 g | |
| D. | 0.5 mol/L Na2SO4 溶液中Na+ 的物质的量是1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com