
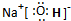 ,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成共价键,
,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成共价键,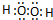 ,故答案为:
,故答案为: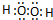 ;
;

科目:高中化学 来源: 题型:
| A、两种物质不能用焰色反应进行鉴别 |
| B、两种物质作为膨松剂的作用原理相同 |
| C、等质量的两种物质中所含铝的质量相同 |
| D、两种物质与足量NaOH溶液共热反应的现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:2 |
| C、2:1 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol?L-1 H2SO4/mL | 30 | V1 | V2 | V3 | 30 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室常用饱和NaHCO3溶液除去CO2中混有的SO2气体 |
| B、打开雪碧的瓶盖,立即有气体逸出 |
| C、经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全 |
| D、合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X和Y一定位于周期表中同一周期 |
| B、X一定是金属元素Y一定是非金属元素 |
| C、X的最高价一定比Y的最高价低 |
| D、X的原子半径一定比Y的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com