
【题目】葡萄酒中常加入亚硫酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验(已知还原性:SO32﹣>I﹣>Cl﹣). ![]()
下列说法不正确的是( )
A.葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的还原性
B.通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出
C.若试剂A选择氯水,则试剂B可选择NaOH标准液
D.若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液
【答案】C
【解析】解:流程的实验原理:样品中加稀硫酸生成二氧化硫,通氮气将生成的二氧化硫从溶液中全部赶出,得到气体为氮气和二氧化硫的混合气体,可以将之通入双氧水中,二氧化硫被氧化成硫酸,再用氢氧化钠中和得中和液含有硫酸钠,据耗碱量可以计算出生成的硫酸的物质的量,利用硫元素守恒可知二氧化硫的质量,结合样品的质量可求得样品中亚硫酸盐含量.
A、亚硫酸根离子易被空气中的氧气氧化为硫酸根,葡萄酒中加亚硫酸盐的主要目的是防止葡萄酒氧化,利用了亚硫酸盐的还原性,故A正确;
B、根据上述分析知道:通氮气是为了将生成的二氧化硫从溶液中全部赶出,故B正确;
C、二氧化硫具有还原性,可以被氯水氧化为硫酸,但是氯水也可以和氢氧化钠之间反应,所以此时不能选择NaOH标准液,故C错误;
D、若试剂A选择碱液,可以和二氧化硫之间反应得到亚硫酸盐或是亚硫酸氢盐,该盐可以被碘单质氧化为硫酸盐,试剂B可选择I2标准液,故D正确.
故选C.
流程的实验原理:样品中加稀硫酸生成二氧化硫,通氮气将生成的二氧化硫从溶液中全部赶出,得到气体为氮气和二氧化硫的混合气体,可以将之通入双氧水中,二氧化硫被氧化成硫酸,再用氢氧化钠中和得中和液含有硫酸钠,据耗碱量可以计算出生成的硫酸的物质的量,利用硫元素守恒可知二氧化硫的质量,结合样品的质量可求得样品中亚硫酸盐含量.


科目:高中化学 来源: 题型:
【题目】在120℃时,已知:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣570kJ/mol
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1130kJ/mol
该温度下,则8gCH4与NO2 完全反应生成N2、CO2、H2O放出热量等于( )
A.1700kJ
B.850kJ
C.425kJ
D.560kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设用NA表示阿伏伽德罗常数的值,其计算近似值为6.02×1023 , 按要求完成下列填空:
(1)0.5mol NH3共含有个原子.
(2)6mol H2O与标准状况下L NH3所含氢原子数相等.
(3)某硫酸钠溶液中含有3.01×1023个Na+ , 则该溶液中SO42﹣的物质的量是 .
(4)标准状况下11.2L NO和g NO2所含有的氧原子数相等.
(5)8g某物质含有3.01×1023个分子,该物质的相对分子质量约为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硅及其化合物的叙述中,不正确的是
A.水玻璃可作粘合剂及耐火材料B.硅可做半导体材料
C.二氧化硅是光导纤维的原料D.氮化硅陶瓷是做电子元件的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,8g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出176kJ的热量,则表示甲醇燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2 (g)+Cl2 (g)=2HCl (g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol E(Cl﹣Cl)=243kJ/mol
则E(H﹣Cl)= ,
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体.在25℃、101kPa下,已知该反应每消耗1mol CuCl(s),放热44.4kJ,该反应的热化学方程式是 .
(4)FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH,CO,H2的浓度都不再发生变化
E.气体的压强不再改变
(2)表所列数据是该反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 .
(3)要提高CO的转化率,可以采取的措施是 .
a.升温 b.加入催化剂 c.增加CO的浓度 d.恒容下加入H2使压强变大
e.恒容下加入惰性气体使压强变大 f.分离出甲醇
(4)在250℃时,测得某密闭容器中各物质的物质的量浓度见表:
CO | H2 | CH3OH |
0.5molL﹣1 | 2molL﹣1 | 6molL﹣1 |
此时反应的正、逆反应速率的关系是:v(正)v(逆)(填“>”“<”或“═”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液与人类生活息息相关,请回答下列问题
(1)某温度下,Kw=1×10﹣12( molL﹣1)2 , 若保持温度不变,向水中滴入稀硫酸恰好使溶液中c(H+)/c(OH﹣)=1×1010 , 则此时水电离出的c(H+)=molL﹣1 .
(2)常温下若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是 .
A.若混合后溶液呈中性,则c(H+)+c(OH﹣)=2×10﹣7mol/L
B.若V1=V2 , 混合后溶液的pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(3)下列曲线中,可以描述乙酸(甲,Ka=1.8×10﹣5 mol/L)和一氯乙酸(乙,Ka=1.4×10﹣3 mol/L)在水中的电离度与浓度关系的是 
(4)在下列实验中,能证明醋酸酸性比盐酸酸性弱的是 .
A.将等体积、pH=4的盐酸和醋酸稀释成pH=5的溶液,测量所需加入水量的多少
B.向等体积、等pH的盐酸和醋酸中分别加入同量的相应钠盐固体,测溶液的pH有无变化
C.向等体积、等浓度的盐酸和醋酸分别加入足量锌粉,测量产生氢气的体积
D.用等体积、等浓度的盐酸和醋酸做导电性实验,根据灯泡的明亮程度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应C(s)+H2O(g)H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图. 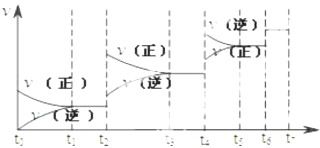
①图中t2到t3段、t4到t6段时引起平衡移动的条件分别可能是、;
②图中表示平衡混合物中CO的含量最高的一段时间是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示。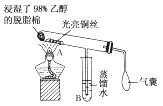
实验操作:预先使棉花团浸透乙醇并照图安装好;在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。请回答以下问题:
(1)被加热的铜丝处发生反应的化学方程式为。
(2)A管中可观察到现象。
从中可认识到在该实验过程中催化剂起催化作用时参加了化学反应,还可认识到催化剂起催化作用时需要一定的。
(3)实验一段时间后,如果撤掉酒精灯,反应(填“能”或“不能”)继续进行。原受热的铜丝处的现象是 , 原因是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com