
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-36 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3 |
| A、向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀 |
| B、该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4 |
| C、当pH=10时,溶液中c(Fe2+):c(Fe3+)=2×1020:1 |
| D、向该溶液中加入适量氨,调节pH到9.6后过滤,将所得的沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物 |
| 8.0×10-16 |
| 10-8 |
| 4.0×10-36 |
| 10-12 |


科目:高中化学 来源: 题型:
| A、“纳米铜”比铜片的金属性强 |
| B、“纳米铜”比铜片更易失去电子 |
| C、“纳米铜“比铜片的氧化性强 |
| D、“纳米铜”的还原性与铜片相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该硫酸的物质的量浓度为9.2mol/L |
| B、常温下1mol铁与足量的该硫酸反应产生3g氢气 |
| C、配制500ml 4.6mol/l的稀硫酸需取该硫酸125ml |
| D、配制稀硫酸时,先向烧杯中加入浓硫酸,再沿玻璃棒慢慢加入适量水,且边加边搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
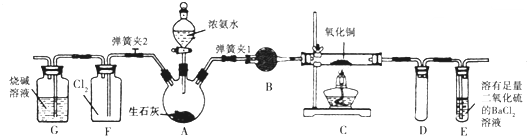
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32 g O2所含的原子数目为NA |
| B、0.5 mol H2O含有NA个氢原子和0.5NA个氧原子 |
| C、1 mol H2O含有的H2O分子数目为NA |
| D、0.5NA个氢气分子的物质的量是0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 预期现象及结论 | |
| 方案1 | 取少量黄色溶液,加入NaOH溶液 | 如果生成红褐色沉淀,则说明发生了反应 |
| 方案2 | 取少量黄色溶液,加入淀粉碘化钾溶液 | 如果溶液变蓝色,则说明未发生反应 |
| 方案3 | 取少量黄色溶液,加入四氯化碳,振荡 | 如果下层溶液呈橙红色,则说明: |
| 实验操作 | 预期现象及结论 | 解释现象的离子方程式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com