
在下列物质转化关系中,反应的条件和部分产物已略去。

回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应。
①反应Ⅰ中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是________(填字母)。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是______________________________________。
③通过比较反应Ⅰ、Ⅱ的反应条件,可得出甲的金属性比乙的金属性________(填“强”或“弱”),比较二者金属性强弱的依据还可以是(写出一种即可)__________________。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应Ⅲ的化学方程式是__________________________________________________。
②反应Ⅰ的另一种产物为有机物,则该有机物的电子式是______________。
③在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。其反应的离子方程式是______________________________________________。
(1)①C ②3Fe+4H2O(g)  Fe3O4+4H2 ③强 元素最高价氧化物对应的水化物的碱性:NaOH>Fe(OH)3(其他合理答案也可)
Fe3O4+4H2 ③强 元素最高价氧化物对应的水化物的碱性:NaOH>Fe(OH)3(其他合理答案也可)
(2)①2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O ②H:C??C:H ③2Cl2+H2O+CaCO3=CaCl2+2HClO+CO2
【解析】(1)由题意知,丙为H2,①甲为Na,制备金属钠用电解法。②乙为铁,3Fe+4H2O(g)  Fe3O4+4H2。③Na在常温下和水剧烈反应,而Fe与H2O(g)需高温下反应,Na的金属性强,比较Na、Fe的金属性强弱,还可以比较它们的最高价氧化物对应的水化物碱性强弱。(2)丙为Ca(OH)2。①2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
Fe3O4+4H2。③Na在常温下和水剧烈反应,而Fe与H2O(g)需高温下反应,Na的金属性强,比较Na、Fe的金属性强弱,还可以比较它们的最高价氧化物对应的水化物碱性强弱。(2)丙为Ca(OH)2。①2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
②CaC2和H2O反应除生成Ca(OH)2外,还生成C2H2,他的电子式为H:C??C:H。③Cl2+H2O HCl+HClO,2HCl+CaCO3=CaCl2+H2O+CO2↑,上述两式合并得2Cl2+H2O+CaCO3=CaCl2+2HClO+CO2。
HCl+HClO,2HCl+CaCO3=CaCl2+H2O+CO2↑,上述两式合并得2Cl2+H2O+CaCO3=CaCl2+2HClO+CO2。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.金属钠在空气中燃烧的火焰呈黄色,是因为生成的Na2O2为淡黄色固体
B.铁丝在Cl2中燃烧有红棕色的烟,是因为生成的FeCl3为红棕色固体
C.过量的铁加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色,说明稀HNO3将Fe氧化为Fe3+
D.取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十四常见有机物及其应用练习卷(解析版) 题型:选择题
下列说法正确的是( )
①乙烯和甲烷可用溴的四氯化碳溶液鉴别 ②用溴水鉴别苯和正己烷 ③用灼烧的方法鉴别羊毛和蚕丝 ④在一定条件下,可用银氨溶液检验成熟苹果中是否含有葡萄糖
A.②④ B.①④ C.①② D.①③
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十六物质结构与性质练习卷(解析版) 题型:填空题
化学中的某些元素是与生命活动密不可分的元素。请回答下列问题:
(1)NH4NO3是一种重要的化学肥料,其中N原子的杂化方式分别是________,NO3—的空间构型为____________。
(2)A、B、C三元素的原子序数依次增大,它们原子的最外层电子排布均为4s1。
①B元素基态原子电子排布式为___________________________________________。
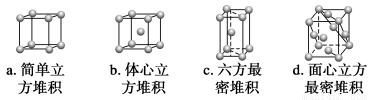
②A元素单质的晶体堆积模型为________(填字母),其空间利用率为__________。
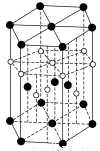
③氢元素与C元素可形成一种红色化合物,其晶体结构单元如下图。则该化合物的化学式为__________(小白球表示H,小黑球表示C)。
(3)已知氮化硼(BN)的一种晶体结构与金刚石相似,则B—N—B之间的夹角是________,氮化硼的密度为3.52 g·cm-3,则B—N键的键长是________pm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十五综合实验探究练习卷(解析版) 题型:填空题
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
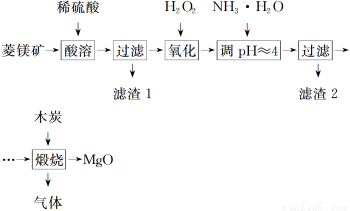
(1)MgCO3与稀硫酸反应的离子方程式为_______________________________________
(2)加入H2O2氧化时,发生反应的化学方程式为____________________________
(3)滤渣2的成分是________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C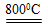 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C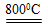 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C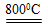 MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
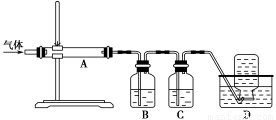
①D中收集的气体是________(填化学式)。
②B中盛放的溶液可以是________(填字母)。
a.NaOH溶液 b.Na2CO3溶液c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:____________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十二常见非金属元素练习卷(解析版) 题型:选择题
下列有关物质的性质与应用不相对应的是( )
A.Na2O2能分别与H2O、CO2反应,可用作供氧剂
B.硅胶多孔、吸水能力强,常用作袋装食品的干燥剂
C.K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净化
D.液氨汽化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十三无机化学综合应用练习卷(解析版) 题型:填空题
Ⅰ.铁盐、亚铁盐是实验室常用的药品。
请根据题意,完成下列填空:
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色。该反应的离子方程式为________________。
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变血红色。继续滴加双氧水,血红色逐渐褪去,且有气泡产生。
写出上述变化中,有关反应的离子方程式:
①____________________________________;
②Fe3++3SCN-=Fe(SCN)3;
③11H2O2+2SCN-=2SO42—+2CO2↑+N2↑+10H2O+2H+
若生成1 mol N2,H2O2和SCN-的反应中转移电子的物质的量是________ mol。
(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为________。
Ⅱ.某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理。
(4)实验前:①先用0.1 mol·L-1 H2SO4洗涤Fe粉,其目的是__________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液通入________(写化学式)。
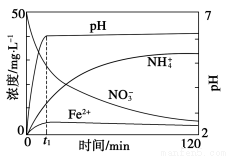
(5)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应生成的阳离子分别是________、________。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
某同学通过系列实验探究铝及其化合物的性质,操作正确且能达到目的的是( )
A.将浓氨水缓慢滴入Al2(SO4)3溶液中,观察Al(OH)3沉淀的生成和溶解
B.将Al(OH)3浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
C.将Al(OH)3沉淀转入蒸发皿中,加热至无水蒸气逸出,得氧化铝固体
D.向Al(OH)3沉淀中分别加入稀硫酸和NaOH溶液探究Al(OH)3的两性
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题五离子反应练习卷(解析版) 题型:选择题
下列各组离子在溶液中能够大量共存,当溶液中c(H+)=10-1 mol·L-1时有气体产生;而当溶液中c(H+)=10-13 mol·L-1时又能生成沉淀。则该组离子可能是( )
A.Na+、Ba2+、NO3-、CO32-
B.Ba2+、K+、Cl-、NO3-
C.Mg2+、NH4+、SO42-、Cl-
D.Fe2+、Na+、SO42-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com