
【题目】如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):
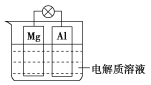
(1)电解质溶液为稀硫酸时,灯泡亮,Mg电极上发生的反应为____________________;Al电极上发生的反应为_____________________________。溶液中![]() 向_____移动(填“Mg电极”或“Al电极”)。当电路中转移0.5 mol电子时,理论上消耗负极材料的质量为___ g。
向_____移动(填“Mg电极”或“Al电极”)。当电路中转移0.5 mol电子时,理论上消耗负极材料的质量为___ g。
(2)电解质溶液为NaOH溶液时,灯泡________(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,Al电极上发生的反应为____________________________。
b.若灯泡不亮,其理由为________________________。
【答案】Mg-2e-=Mg2+ 2H++2e-=H2↑ 镁电极 6 亮 ![]() 无
无
【解析】
(1)电解质溶液为稀硫酸时,灯泡亮,形成原电池,镁比铝活泼,镁作负极,电极反应为Mg-2e-=Mg2+,铝作正极,电极反应为2H++2e-=H2↑,据此分析判断并计算解答;
(2)金属镁和铝为电极材料,电解质溶液为稀NaOH时,由于镁不能与氢氧化钠反应,而金属铝能与氢氧化钠溶液反应生成偏铝酸钠(或四羟基合铝酸钠)溶液和氢气,所以铝为负极,镁为正极,据此分析解答。
(1)电解质溶液为稀硫酸时,灯泡亮,形成原电池,镁比铝活泼,镁作负极,电极反应为Mg-2e-=Mg2+,铝作正极,电极反应为2H++2e-=H2↑,原电池中阴离子向负极移动,![]() 向镁电极移动,根据负极电极反应:Mg-2e-=Mg2+,消耗1mol镁,转移2mol电子,则转移0.5 mol电子时,消耗镁电极0.25mol,其质量为0.25mol×24g/mol=6g;
向镁电极移动,根据负极电极反应:Mg-2e-=Mg2+,消耗1mol镁,转移2mol电子,则转移0.5 mol电子时,消耗镁电极0.25mol,其质量为0.25mol×24g/mol=6g;
(2)金属镁和铝为电极材料,电解质溶液为稀NaOH时,由于镁不能与氢氧化钠反应,而金属铝能与氢氧化钠溶液反应生成偏铝酸钠(或四羟基合铝酸钠)溶液和氢气,所以铝为负极,镁为正极,该装置构成原电池,则灯泡亮,正极的电极反应为6H2O+6e-=3H2↑+6OH-,负极的电极反应为![]() 。
。


科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示。下列说法正确的是
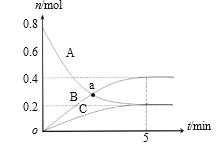
A.a点时,υ(A) =υ(B)
B.反应开始到5min,B的物质的量增加了0.2 mol
C.反应的化学方程式为:3A![]() 2B+C
2B+C
D.反应开始到5min,υ(C) =0.04 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 N2、H2 的混合气体分别充入甲、乙、丙三个容器中,进行N2 + 3H2 ![]() 2NH3的反应,测得反应速率分别为:甲:v(H2)=1 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率
2NH3的反应,测得反应速率分别为:甲:v(H2)=1 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率
A.v(甲)>v(乙)>v(丙)B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙)D.v(乙)>v(甲)>v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是一种重要的有机中间体,可以由苯合成,具体合成路线如下:

(1)J的化学式为__________________ ;F的名称为__________________。
(2)B中官能团名称为____________________ 。
(3)I—J的反应类型为____________________ 。
(4)F -G的反应方程式为____________________ 。
(5)与I属于同种类型物质且苯环上有两个取代基的同分异构体有____种。符合下列条件的J的一种同分异构体结构简式为______。
①属于芳香族化合物 ②不能与金属钠反应 ③有3种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
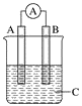
A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池充放电的总反应为:![]() ,下列关于铅蓄电池的说法正确的是( )
,下列关于铅蓄电池的说法正确的是( )
A. 在放电时,两极质量均增加
B. 在充电时,电池中硫酸的浓度不断变小
C. 在放电时,负极发生的反应是 Pb + 2e- + SO42-=PbSO4
D. 在放电时,正极发生的反应是 PbSO4 + 2e- =Pb + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用请化学用语回答有关问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)C和H的元素符号是______和_______;
(2)表中A与F的氢化物反应的化学方程式___________,E的单质与其下一周期同族元素的最高价氧化物在高温下反应的化学方程式___________;最不活泼的元素________(填写元素符号)
(3)表中所列元素中最高价氧化物对应水化物碱性最强的是___________,酸性最强的是______ (填写化学式)
(4)表中能形成两性氢氧化物的元素是__________(填写元素符号),写出该元素的氢氧化物与A的最高价氧化物对应水化物反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种烃的衍生物A和B,所含碳、氢、氧的质量比均为6∶1∶4。完全燃烧0.1 mol A能生成3.6 g水。B只含一个醛基,1.1g B与足量银氨溶液反应,可析出2.7 g Ag。则下列关于物质A和物质B的判断正确的是
A. 物质A一定是乙醛
B. 物质A和物质B互为同分异构体
C. 物质B的同分异构体中既含有醛基又含有羟基的有6种
D. 物质B属于酯类的同分异构体有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com