
【题目】X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物(ZXY)2的结构式如图所示。下列说法错误的是
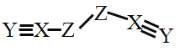
A.化合物WY是良好的耐热冲击材料
B.Y的氧化物对应的水化物可能是弱酸
C.X的氢化物的沸点一定小于Z的
D.化合物(ZXY)2中所有原子均满足8电子稳定结构
【答案】C
【解析】
因W的最外层电子数比X的最外层电子数少1个,且原子序数W>X,因此X、Y、Z为第二周期元素,W为第三周期元素,结合(ZXY)2的结构式可知,X为C,Y为N,Z为O,X最外层电子数为4,故W为Al,以此解答。
A.化合物AlN为原子晶体,AlN最高可稳定到2200℃,室温强度高,且强度随温度的升高下降较慢,导热性好,热膨胀系数小,是良好的耐热冲击材料,故A不符合题意;
B.N的氧化物对应的水化物中HNO2为弱酸,故B不符合题意;
C.C的氢化物的沸点随分子量的增加而增大,沸点不一定比H2O的沸点低,故C符合题意;
D.由(OCN)2的结构式可知所有原子均满足8电子稳定结构,故D不符合题意;
故答案为:C。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol甲醇分子中含有的共价键数为4NA
B.2.4 g镁在足量的氧气中燃烧,转移的电子数为0.1NA
C.标准状况下,5.6 L二氧化碳气体中含有的氧原子数为0.5NA
D.1 L 0.5 mol/L CH3COONa溶液中含有的CH3COO-数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -144 | 78.0 | 0.789 |
乙酸 | 16.6 | 118 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓硫酸(98%) | - | 338 | 1.84 |
下图为实验室制取乙酸乙酯的装置图。
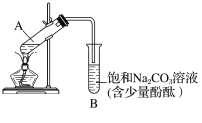
(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象为________(填字母)。
A.上层液体变薄
B.下层液体红色变浅或变为无色
C.有气体产生
D.有果香味
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:
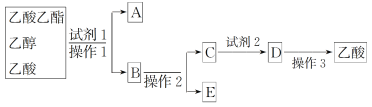
①试剂1最好选用_________________________________________________;
②操作1是________,所用的主要仪器名称是__________________________;
③试剂2最好选用_____________________________________;
④操作2是_______________________________________;
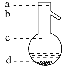
⑤操作3中温度计水银球的位置应为下图中________(填“a”“b”“c”或“d”)所示,在该操作中,除蒸馏烧瓶、温度计外,还需要的玻璃仪器有__________、________、________、________,收集乙酸的适宜温度是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1273K、100.0kPa条件下,乙烷生成乙烯的反应C2 H6(g)![]() C2 H4(g)+H2(g)达到平衡后
C2 H4(g)+H2(g)达到平衡后
A. C2 H6的浓度保持不变
B. C2 H6仍在不断分解,其浓度不断减小
C. C2 H6的分解速率大于生成速率
D. C2 H4仍在不断生成,其浓度不断增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是( )
A.SO3 + H2O === H2SO4B.CaCO3 === CaO + CO2↑
C.Zn + H2SO4 === ZnSO4 + H2↑D.AgNO3 + NaCl![]() AgCl↓+ NaNO3
AgCl↓+ NaNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应方程式书写错误的是( )
A.![]() +HO-NO2(浓)
+HO-NO2(浓)![]()
![]() +H2O
+H2O
B.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
C.2CH3CH2OH+O2![]() 2CH3CHO
2CH3CHO
D.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:
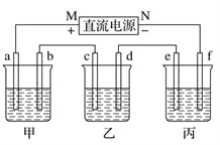
(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )
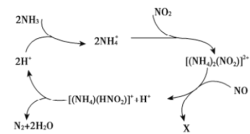
下列说法正确的是( )
A.反应过程中NO2、NH4+之间的反应是氧化还原反应
B.上述历程的总反应可以为:2NH3+NO+NO2 2N2+3H2O
2N2+3H2O
C.X是HNO2,是还原产物
D.[(NH4)(HNO2)]+是反应过程中的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-水解程度增大,故碱性增强,该反应的离子方程式为_____。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3并推断Na2CO3的水解程度______NaHCO3 (填”大于”或”小于”)。丙同学认为甲、乙的判断都不充分。
丙认为: (1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则____(填”甲”或”乙”)判断正确。试剂X是____。
A.Ba(OH)2溶液 B.BaCl2溶液 C.AlCl3溶液 D.澄清石灰水
(2)查阅资料发现NaHCO3的分解温度为150℃,丙断言____(填”甲”或”乙”)的判断是错误的,理由是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com