
水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO。从中提取钴的主要工艺流程如下: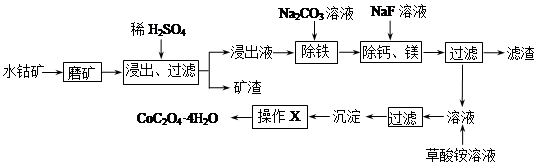
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应为:MgSO4+2NaF=MgF2↓+Na2SO4 ;CaSO4+2NaF=CaF2↓+Na2SO4
已知Ksp(CaF2)=1.11×10-10,Ksp(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中 。
。
(4)“沉淀”中含杂质离子主要有SO42-、F-、 和 ;“操作X”包括 和 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图所示)。电池反应为LiCoO2+C6  CoO2+LiC6,写出该电池放电时的正极反应式 。
CoO2+LiC6,写出该电池放电时的正极反应式 。
(16分)(1)12(2分),90(2分)
(2)3,6,6,1,5,6(2分)
3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6 (SO4)4(OH)12↓+5Na2SO4+6CO2↑
(3)1.5(3分)
(4)NH4+(1分)、Na+(1分);洗涤(1分)、干燥(1分)
(5)CoO2 + Li+ + e-=LiCoO2(3分)
解析试题分析:(1)读图可知,升高温度,钴的浸出率逐渐增大,因此60℃时生产效率太低,90℃时的生产效率与120℃时的生产效率相差不明显,但是120℃时生产成本远远大于90℃时生产成本;因此最佳浸出温度为90℃,而最佳浸出时间为12h;(2)观察可知,该反应不涉及氧化还原反应,可以用设1法配平;设Na2Fe6(SO4)4(OH)12的系数为1,根据铁原子守恒可得Fe2(SO4)3的系数为3;根据硫原子守恒可得Na2SO4的系数为5,根据钠原子守恒可得Na2CO3的系数为6,根据碳原子守恒可得CO2的系数为6,根据氢原子守恒可得H2O的系数为6,即3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6 (SO4)4(OH)12↓+5Na2SO4+6CO2↑;(3)c(Ca2+)/c(Mg2+)=[c(Ca2+)?c2(F-)]/[c(Mg2+)?c2(F-)]= Ksp(CaF2)/ Ksp(MgF2)=(1.11×10-10)/( 7.40×10-11)=1.5;(4)沉淀中所含杂质离子来自可溶性盐电离,可溶性盐来自沉淀步骤之前发生的反应,即加入稀硫酸酸浸时引入的硫酸根离子,加入碳酸钠除铁时引入的钠离子,加入氟化钠除去钙、镁时引入的氟离子,加入草酸铵沉淀钴离子时引入的铵根离子;除去四水合草酸钴沉淀中混有的可溶性物质,常用洗涤、干燥等操作;(5)放电时电池总反应为CoO2+LiC6=LiCoO2+C6,钴元素由+4降为+3价,锂元素由合金中的0升为+1价,则负极反应式为Li—e-=Li+,阳离子移向正极,则锂离子移向正极并参与正极上的反应,所以正极反应式为CoO2+ e-+ Li+= LiCoO2。
考点:考查有关物质制备的化学工艺流程,涉及钴浸出率的温度和时间图像分析、配平化学方程式、溶度积的计算、关键流程所涉及的反应原理、混合物分离与提纯的操作、新型充电电池的正极反应式等。


科目:高中化学 来源: 题型:单选题
下列装置能达到实验目的的是



① ② ③ ④
| A.用①装置制取干燥的氨气 | B.用②装置除去淀粉溶液中的NaCl |
| C.③装置可用于氨气的收集、检验 | D.④装置可用排空气法收集氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验设计或实验操作中,正确的是
| A.铜与浓硝酸反应制NO2:可采用下图装置 |
| B.分离乙酸和乙醇溶液:用分液漏斗进行分离 |
| C.稀硫酸和锌粒反应制取氢气:加入少许硫酸铜以加快反应速率 |
| D.鉴别Na2CO3溶液和NaHCO3溶液:分别向两种溶液滴加澄清石灰水至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
(1)双氧水的结构式为: ;Ⅰ中发生反应的还原剂是 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式 。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填相同、不相同或无法判断)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~10nm之间).下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题.
(1)实验室制备NH3的反应方程式:_______________________________;
(2)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接 , 接 , 接h;
(3)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是 ,试写出制纳米级碳酸钙的离子方程式 ;
(4)在浓CaCl2溶液和NH3用量正确的情况下,CO2不足或过量都会导致纳米级碳酸钙产量下降,若CO2过量溶液中大量存在的离子有(不考虑弱电解质的电离和盐类水解产生的少量离子)________________,
(5)取反应后去除了CaCO3的溶液分别做以下实验,下列实验判断合理的是:_________.
| A.滴加少量Na2CO3溶液,若有沉淀说明CO2一定不足 |
| B.滴加少量盐酸,若有气泡,CO2一定过量 |
| C.测量溶液pH,若大于7,CO2一定不足量 |
| D.滴加少量BaCl2溶液,若无沉淀,CO2一定没有过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
I.ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
(1)滤渣1的化学式为 ;②中使用的氧化剂最好是下列的 (填序号)。
| A.Cl2 | B.H2O2 | C.KMnO4 | D.浓HNO3 |

查看答案和解析>>
科目:高中化学 来源: 题型:问答题
工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为___________;
②硫酸钠和焦炭、石灰石反应的化学方程式为_________(已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
| | |
| |  |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
乙酸乙酯是无色具有水果香味的液体,沸点为77.2 ℃,实验室某次制取它用冰醋酸14.3 mL、95%乙醇 23 mL。还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合成六水合物的氯化钙溶液。主要装置如图所示: 
实验步骤:
①先向A中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用。这时分液漏斗里冰醋酸和乙醇的物质的量之比约为5∶7。
②加热油浴保温约135 ℃~145℃
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加入速率使蒸出酯的速率与进料速率大体相等,直到加料完成。
④保持油浴温度一段时间,至不再有液体馏出后,停止加热。
⑤取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止。
⑥将⑤的液体混合物分液,弃去水层。
⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品。
试回答:
(1)实验中浓硫酸的主要作用是__________ _______。
(2)用过量乙醇的主要目的是________ _________。
(3)用饱和Na2CO3溶液洗涤粗酯的目的是________ ___。
如果用NaOH溶液代替Na2CO3溶液将引起的后果___________________________________。
(4)用饱和CaCl2溶液洗涤粗酯的目的是_____ ______。
(5)在步骤⑧所得的粗酯里还含有的杂质是______ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)氯酸钾热分解是实验室制取氧气的一种方法,某探究小组查阅资料得知,氯酸钾在不同条件下分解结果如下:
| 实验 | 反应体系 | 第一放热峰温度(℃) | 第二放热峰温度(℃) |
| l | KC1O3 | 400(无气体放出) | 480(有少量气体放出) |
| 2 | KC1O3+MnO2 | 350(有大量气体放出) | |
 KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。
KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。| 实验步骤 | 实验现象 | 实验结论 |
| 将产生的气体接触湿润的淀粉碘化钾试纸 | | 假设l正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| | | 假设2正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com