
����Ŀ��ʵ������ȡ�����Ļ�ѧ����ʽ��4HCl��Ũ��+MnO2 ![]() Cl2��+MnCl2+2H2O��
Cl2��+MnCl2+2H2O��
��1����Ӧ��HCl����Ԫ�صĻ��ϼ� ��
��2���ڸ�������ԭ��Ӧ�У�MnO2 ��������Ԫ�ر� �� ��HCl�ڷ�Ӧ�б��ֵ����ʰ����� ��
��3������6molCl2����ʱ����Ӧ��ת��mol���ӣ�
��4��д���÷�Ӧ�����ӷ���ʽ �� ��˫���ŷ��������ת�Ƶķ������Ŀ�� ��
���𰸡�
��1����1��
��2������,��ԭ,����,��ԭ��
��3��12
��4��4H++2Cl��+MnO2 ![]() Mn2++Cl2��+2H2O,
Mn2++Cl2��+2H2O,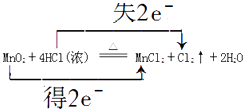
���������⣺��1����Ӧ��HCl��HΪ+1�ۣ���Ԫ�صĻ��ϼ�Ϊ��1�ۣ�
���Դ��ǣ���1�ۣ�
��2���ڸ�������ԭ��Ӧ�У�MnԪ�صĻ��ϼ۽��ͣ�MnO2 ������������Ԫ�ر���ԭ����HCl�ڷ�Ӧ�б��ֵ����ʰ������Ժͻ�ԭ�ԣ�
���Դ��ǣ���������ԭ�����ԣ���ԭ�ԣ�
��3������6molCl2����ʱ����Ӧ��ת��6mol��2����1��0��=12mol���ӣ�
���Դ��ǣ�12��
��4���÷�Ӧ�����ӷ���ʽΪ4H++2Cl��+MnO2 ![]() Mn2++Cl2��+2H2O���÷�Ӧ��ת�Ƶ�����Ϊ2e��������ת�Ʒ������ĿΪ
Mn2++Cl2��+2H2O���÷�Ӧ��ת�Ƶ�����Ϊ2e��������ת�Ʒ������ĿΪ  ��
��
���Դ��ǣ�4H++2Cl��+MnO2 ![]() Mn2++Cl2��+2H2O��
Mn2++Cl2��+2H2O��  ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״����CH4��HCl��H2S��NH3��Ϊ���壮�ڱ�״���·ֱ��Т�13.44L CH4��1molHCl���� ��27.2gH2S ��2.408��1023��NH3���ӣ�����˵����ȷ���ǣ�������
A.������ڣ��ۣ��ܣ���
B.�ܶȣ��ڣ��ۣ��٣���
C.�������ڣ��ۣ��ܣ���
D.Hԭ�Ӹ������٣��ۣ��ܣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У������ķ�������ͬ���ǣ�������
A.10g H2��10g O2
B.5.6L N2��0.25mol CO2
C.0.5 NA��H2O��0.5mol I2
D.32g O2��32g O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������з������淴Ӧ4NH3��g��+5O2��g��4NO��g��+6H2O��g���������Dz�ͬ����µķ�Ӧ���ʣ����������ǣ� ��
A.v��O2��=0.01 molL��1s��1
B.v��NH3��=0.02molL��1s��1
C.v��H2O��=0.06 molL��1min��1
D.v��NO��=0.03molL��1s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��һЩ���ʻ�����Ĵ�����ϵ�в���ȷ���ǣ�������
X | Y | Z | |
A | ������ | ������ | ������ |
B | �Ȼ��� | ����� | ������ |
C | ���������� | ���������� | ������ |
D | ţ�� | ���� | ��ɢϵ |
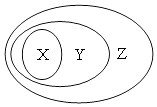
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. �������ʹ���Ը��������Һ��ɫ
B. ���������������ķ�Ӧ����ȡ����Ӧ
C. ������Cl2��Ӧ��������ֻ��һ�ȼ�����Ȼ���
D. ������ӵĹ���Ϊƽ���ı��Σ�C��H���ij��Ⱥͼн���ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���aL�ܱ������м���1mol X�����2mol Y���壬�������·�Ӧ��X��s��+2Y��g��2Z��g�������жϸ÷�Ӧ��ƽ��״̬���ǣ� ��
A.����������ѹǿ����ʱ��仯
B.�����������ܶȲ���ʱ��仯
C.������X��Y��Z��Ũ��֮��Ϊ1��2��2
D.X���������ʺ�Z����������֮��Ϊ1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ظ���Cr������Һ����Ҫ��Cr3+������ɫ����Cr��OH��4������ɫ����Cr2O72�����Ⱥ�ɫ����CrO42������ɫ������ʽ���ڣ�Cr��OH��3Ϊ������ˮ�Ļ���ɫ���壬�ش�
��1��Cr3+��Al3+�Ļ�ѧ�������ƣ���Cr2��SO4��3��Һ�е���NaOH��Һֱ���������ɹ۲쵽�������� ��
��2��CrO42����Cr2O72������Һ�п��ת���������£���ʼŨ��Ϊ1.0molL��1��Na2CrO4��Һ��c��Cr2O72������c��H+���ı仯��ͼ��ʾ�� 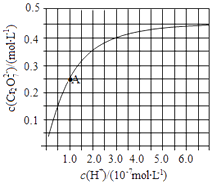
�������ӷ���ʽ��ʾNa2CrO4��Һ�е�ת����Ӧ ��
����ͼ��֪����Һ������ǿ��CrO42����ƽ��ת�����������С�����䡱����
����A�����ݣ��������ת����Ӧ��ƽ�ⳣ��Ϊ ��
��3����K2CrO4Ϊָʾ������AgNO3��Һ�ζ���Һ�е�Cl�� �� Ag+��CrO42������ש��ɫ����ʱ����ζ��յ㣮����Һ��Cl��ǡ����ȫ������Ũ�ȵ���1.0��10��5molL��1��ʱ����Һ��c ��Ag+��ΪmolL��1 �� ��ʱ��Һ��c��CrO42��������molL��1 �� ��Ksp��Ag2CrO4��=2.0��10��12��Ksp��AgCl��=2.0��10��10����
��4��+6�۸��Ļ����ﶾ�Խϴ���NaHSO3����Һ�е�Cr2O72����ԭ��Cr3+ �� ��Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������п�����������Ҫ��Ⱦ��Ϊ�����������pm2.5��NOx��SO2�ȣ�����Ҫ��ԴΪȼú�ͻ�����β���ŷŵȣ�
��1��ijͬѧΪ��������������ɷݣ�������������ˮ�����Ƴɴ������������ʵ�鼰ʵ��������ͼ��
�ٸ�ʵ����ȷ�ϴ��ڵ��������� ��
�ڸ�ʵ�������������NO3�� �� �����ǣ��û�ѧ����ʽ���ͣ� ��
�۸��ݸ�ʵ���ܷ�ȷ�������к���SO32�� �� ����ܡ�������Ҫȷ��SO32�� �� �����ʵ��ҩƷ������ ��
��2��PM2.5��ָ������ֱ��С�ڻ����2.5��m��1��m=103nm���Ŀ��������˵������ȷ����������ĸ��ţ���
a��PM2.5��Ҫ��Դ�ڻ������硢��ҵ����������β���ŷŵȹ���
b��PM2.5����С�����Զ�������
c��ֱ������1��2.5��m�Ŀ������ɢ�������п��γɽ���
d���ƹ�ʹ�õ綯���������Լ���PM2.5����Ⱦ
��3�����й�����������ʱ���о�������ʯ�������ҵȼúβ���е���SO2��SO3���͵���NO��NO2�����¹��գ����ܾ���β�������ܻ��Ӧ�ù㷺��CaSO4��Ca��NO2��2 �� 
��CaSO4���Ե���ˮ���Ӳ��ʱ�䣮β����SO2��ʯ���鷴Ӧ����CaSO4�Ļ�ѧ����ʽΪ ��
��Ca��NO2��2���Ƴɻ��������������ֽ�������ȣ�β����NO��NO2��ʯ���鷴Ӧ����Ca��NO2��2�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com